多篇重要研究成果解读近期科学家在机体肠道菌群研究领域取得的新进展!
来源:生物谷原创 2023-04-28 14:31
如今大量研究证据表明,机体肠道菌群对于人类健康非常重要,且与多种疾病的发生直接相关,本文中,小编整理了科学家们近期在肠道菌群研究领域取得的新进展,分享给大家!
如今大量研究证据表明,机体肠道菌群对于人类健康非常重要,且与多种疾病的发生直接相关,本文中,小编整理了科学家们近期在肠道菌群研究领域取得的新进展,分享给大家!
【1】Nat Med:肠道微生物组在CAR-T细胞癌症免疫治疗中发挥关键作用
doi:10.1038/s41591-023-02234-6
近日,一篇发表在国际杂志Nature Medicine上题为“A non-antibiotic-disrupted gut microbiome is associated with clinical responses to CD19-CAR-T cell cancer immunotherapy”的研究报告中,来自德国癌症研究中心等研究机构的科学家们通过研究发现肠道微生物组可能调节对CAR-T细胞疗法在治疗B细胞淋巴瘤患者时的疗效。在开始CAR-T细胞疗法治疗之前,从患者的肠道微生物组中获得的个性化肠道微生物组信息可以准确预测他们随后对这种治疗的反应性,但条件是这些患者没有预先进行广谱抗生素治疗。

抗生素暴露对靶向CD19的CAR-T细胞治疗淋巴瘤患者生存结局和毒副作用产生的影响
图片来源:Nature Medicine, 2023, doi:10.1038/s41591-023-02234-6
来自人体研究和临床前实验的越来越多的证据表明,肠道微生物组可能会调节T细胞驱动的癌症免疫疗法(比如免疫检查点阻断)的疗效。靶向CD19的CAR-T细胞疗法(下称CD19 CAR-T细胞疗法)为某些形式的难治性和复发性B细胞白血病或淋巴瘤患者提供了新的治疗选择。但是这种免疫疗法因在反应性方面存在相当大的异质性而受到阻碍。最多只有40%的患者能获得完全和长期缓解。
在这项新的研究中,这些作者发现肠道微生物组可能调节CD19 CAR-T细胞疗法在治疗B细胞白血病和淋巴瘤患者时的的疗效。这项规模最大的前瞻性研究对172名先前多轮化疗失败的淋巴瘤患者进行了跟踪,从CAR-T细胞疗法启动前一直到启动两年后。有趣的是,20%接受诸如美罗培南(meropenem)、哌拉西林-他唑巴坦(piperacillin–tazobactam)或头孢吡肟(cefepime)之类的广谱(“高风险”)抗生素治疗的患者,与接受其他抗生素治疗的患者和治疗前未使用抗生素的患者相比,对随后的CAR-T细胞治疗的临床反应有所改变。
【2】Sci Immunol:健康的肠道细菌可以帮助对抗身体其它部位的癌症
doi:10.1126/sciimmunol.abo2003
近日,一篇发表在国际杂志Science Immunology上题为“Immune checkpoint blockade induces gut microbiota translocation that augments extraintestinal antitumor immunity”的研究报告中,来自美国德克萨斯大学西南医学中心的研究人员发现健康的肠道细菌如何能够逃离肠道,进入淋巴结和身体其他部位的癌性肿瘤,并提高某些免疫治疗药物的效果,这一发现阐明了为何抗生素会削弱免疫疗法的效果,并可能带来新的癌症治疗方法。
研究者Andrew Y. Koh博士表示,科学家们一直对机体肠道内的细菌如何对你的肺部、乳房或皮肤中的癌症产生影响感到疑惑。如今我们对这一机制有了更多的了解,并希望在未来利用这一知识更好地抗击癌症。此前的研究已经显示出了肠道微生物组(在消化道内发现的微生物)的组成与靶向免疫系统的癌症治疗---包括派姆单抗(pembrolizumab, 商品名为Keytruda)和易普利姆玛(ipilimumab, 商品名为Yervoy)---的效果之间的关联性。然而,在现有的研究中,科学家们在优化治疗的理想微生物平衡问题上得出了相互矛盾的结论,指向了不同的有益细菌。
Koh博士及其同事们利用携带黑色素瘤的小鼠来探究这些称为免疫检查点抑制剂的免疫治疗药物如何影响肠道微生物在体内的运动。他们发现,免疫检查点抑制剂提高了免疫系统对抗肿瘤的活性,也引起了消化系统的炎症,导致了肠道内淋巴结的重塑。
【3】J Hepatol:新发现!肠道菌群对于机体肝脏的修复至关重要!
doi:10.1016/j.jhep.2022.12.028
当机体肝脏的一部分被切除时,机体就会替代缺失的组织;近日,一篇发表在国际杂志Journal of Hepatology上题为“Gut microbiota promote liver regeneration through hepatic membrane phospholipid biosynthesis”的研究报告中,来自德国慕尼黑大学等机构的科学家们通过研究发现,上述过程的成功或许在很大程度上依赖于机体的肠道菌群,其或能帮助改善肝癌和其它疾病的患者肝脏手术后的预后情况。
人类的肝脏具有惊人的再生能力,其与心脏不同;其背后潜在的生物学机制就是机体的肠道菌群在其它器官发生过程中发挥作用的一个很好的例子,这项研究中,研究人员通过联合研究就为了证明这一点。健康的肠道微生物组包括多种类型的细菌,其在消化过程中发挥着积极的作用,比如,其中一部分肠道菌群能将碳水化合物分解成为短链脂肪酸(SCFAs),肝脏细胞需要这些脂肪酸来生长和分裂;如今研究人员首次成功揭示了,肠道菌群会影响肝脏细胞中的脂质代谢,以及其再生的能力。
研究者Janssen等人通过对小鼠进行实验确定了被干扰的微生物组如何影响机体肝脏的再生,在通过抗生素来干扰肠道微生物组的动物机体中,研究者发现了新生肝脏细胞的形成被明显推迟了。如今科学家们已经意识到了抗生素和肝脏再生功能被干扰之间的关联,然而这在此前归因于机体的免疫反应或抗生素对肝脏细胞的有害副作用;这项研究中研究人员才开始发现其与肠道菌群之间的机制性关联,基于对利用抗生素治疗的小鼠进行研究,出生时就缺乏微生物组的小鼠机体的肝脏细胞并不会发生再生。研究者解释道,抗生素并没有杀灭所有的肠道菌群,然而,疗法会改变微生物组的组成,剩余的细菌群落会产生较少的短链脂肪酸,而微生物组通常会在抗生素疗法后的几周内恢复。
【4】Nature:揭示肠道菌群影响人类胰腺癌疗法疗效的分子机制
doi:10.1038/s41586-023-05728-y
由于转移性疾病的高发病率且对疗法的反应有限,科学家们预计到2040年,胰腺导管腺癌(PDAC)将会成为人类第二大致命性的癌症类型;仅有不到一半的患者会对针对PDAC的主要疗法—化疗产生反应,然而仅靠遗传改变却并不能解释这种情况;饮食是一种会影响患者对疗法反应的环境因素,但其在PDAC发生过程中所扮演的关键角色,研究人员并不清楚。
近日,一篇发表在国际杂志Nature上题为“Microbiota-derived 3-IAA influences chemotherapy efficacy in pancreatic cancer”的研究报告中,来自德国汉堡大学医学中心等机构的科学家们通过研究发现了肠道菌群积极影响癌症疗法的一些通路;文章中,研究者分析了肠道微生物对接受化疗的胰腺导管腺癌治疗效应的影响。
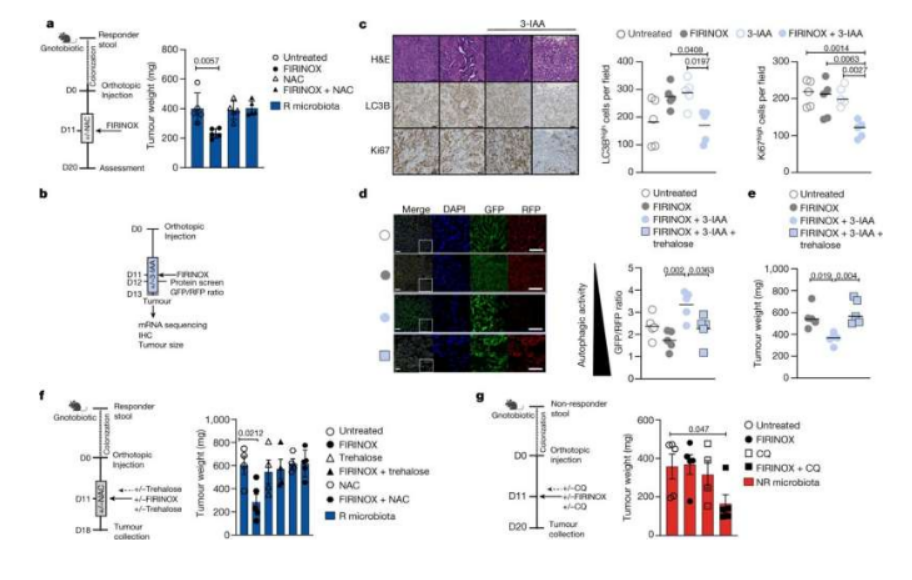
揭示肠道菌群影响人类胰腺癌疗法疗效的分子机制。
图片来源:Nature (2023). DOI:10.1038/s41586-023-05728-y
此前研究结果表明,化疗在治疗发生转移的胰腺癌上有时能发挥疗效,但有时却没有任何效果,这种差异或许与机体对饮食的抵抗有关,尽管其来源研究人员尚不清楚。这项研究中,研究人员分析了肠道微生物组中的特定微生物在其中扮演关键作用的可能性,首先他们分析了来自胰腺癌患者机体肠道微生物组的样本,结果发现对疗法能产生反应和无法产生反应的患者之间存在一些差异,同时他们还发现,接受来自对化疗能产生反应的小鼠机体的生物组样本的无菌肠道的小鼠也会对化疗产生很好的反应。
【5】Science:震惊!肠道微生物组在哺乳动物的大脑健康中起着关键作用
doi:10.1126/science.add1236
越来越多的证据表明,通常生活在我们肠道中的数万亿个微生物---所谓的肠道微生物组---对我们身体的功能有着深远的影响。这个微生物群落的成员产生维生素,帮助我们消化食物,防止有害细菌的过度生长,调节免疫系统,以及其他好处。近日,一篇发表在国际杂志Science上题为“ApoE isoform– and microbiota-dependent progression of neurodegeneration in a mouse model of tauopathy”的研究报告中,来自美国华盛顿大学圣路易斯医学院的研究人员通过研究发现肠道微生物组在我们的大脑健康中也起着关键作用。
这项新的研究在小鼠身上发现,肠道细菌---部分是通过产生短链脂肪酸等化合物---影响整个身体的免疫细胞的行为,包括大脑中的免疫细胞,这些免疫细胞可以损害脑组织并加剧阿尔茨海默病等疾病中的神经退化。这一发现为重塑肠道微生物组作为预防或治疗神经变性的一种方式提供了可能性。
研究者David M. Holtzman博士表示,我们给年轻的小鼠服用抗生素仅一周,我们观察到它们的肠道微生物组、它们的免疫反应以及与一种叫做tau的蛋白有关的神经变性的程度随着年龄的增长而发生了永久性变化。令人激动的是,操纵肠道微生物组可能是对大脑产生影响的一种方式,而不需要将任何东西直接放入大脑。”越来越多的证据表明,阿尔茨海默病患者的肠道微生物组可能与健康人的不同。但目前还不清楚这些差异是这种疾病的原因还是结果(或者两者都是)以及改变肠道微生物组对这种疾病的过程可能有什么影响。
【6】Cell:首次发现母亲和婴儿机体肠道微生物组之间或许存在水平基因转移现象
doi:10.1016/j.cell.2022.11.023
围产期是机体认知和免疫系统发育的关键窗口,其会通过母体和婴儿的肠道微生物组以及其代谢产物而促进。近日,一篇发表在国际杂志Cell上题为“Mobile genetic elements from the maternal microbiome shape infant gut microbial assembly and metabolism”的研究报告中,来自赫尔辛基大学等机构的科学家们通过研究发现了一种新型的母婴微生物组传播模式,即在围产期内母体肠道中的微生物会与婴儿肠道中的微生物共享基因,而且这种模式从婴儿出生前就开始了,并且会延伸到其出生后的头几周,这种水平基因转移就能允许母源性的微生物影响婴儿机体微生物组的功能,而微生物组菌株本身并没有进行持续性的传播。
在这篇大规模的综合性分析中,研究人员提供了一系列肠道定植动态学变化的高分辨率快照信息,这种动态学变化或许会影响婴儿出生前后的机体发育。研究者Ramnik Xavier说道,这项研究中,我们首次描述了母体和婴儿机体微生物组移动遗传元件的转移,同时我们还整合了来自母亲和婴儿体内的肠道微生物组及其代谢组学特征,结果发现了肠道代谢产物、细菌和母乳底物之间的关联,这项调查代表了在已知的母源性和膳食因素的影响下,婴儿肠道微生物组和代谢组共同发育的独特视角。
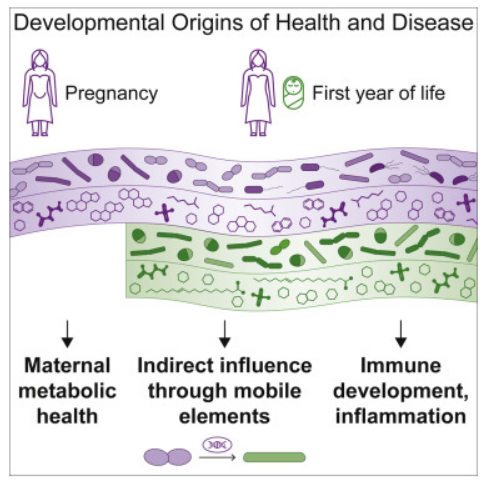
首次发现母亲和婴儿机体肠道微生物组之间或许存在水平基因转移现象。
图片来源:Cell (2022). DOI:10.1016/j.cell.2022.11.023
肠道菌群能部分通过微生物代谢产物的产生来促进机体免疫系统的成熟,婴儿肠道微生物组的发育遵循着可预测的模式,即从出生时母亲传递的微生物开始,除了免疫系统成熟外,微生物的代谢产物还影响着机体早期的认知功能发育。围产期对于机体认知和免疫系统的发育非常关键,尽管如此,在围产期机体微生物组和代谢组的共同发育以及这一过程的决定因素,科学家们并未很好地理解。为了填补这一知识空白,研究人员对来自70个母婴组合队列的纵向多组学数据进行分析,从孕晚期到婴儿出生一岁时追踪其与母亲体内的微生物组和代谢组的共同发育情况,结果发现了大规模的母亲-婴儿机体之间移动遗传元件的转移,其经常涉及与饮食相关的适应性存在关联的基因。
【7】Nat Metabol:肠道微生物组在塑造机体血液代谢组上扮演着特殊的角色
doi:10.1038/s42255-022-00670-1
血液代谢组的变化与人类机体健康密切相关,然而,关于遗传学和微生物组之间的相互作用在逐个代谢产物的层面上解释这种变化的细节,研究人员却知之甚少。近日,一篇发表在国际杂志Nature Metabolism上题为“Genome–microbiome interplay provides insight into the determinants of the human blood metabolome”的研究报告中,来自美国系统生物学研究所等机构的科学家们通过研究揭示了与机体肠道微生物组、遗传学或两者之间发生相互作用的特殊血液代谢产物,相关研究结果或有望帮助指导科学家们开发靶向性疗法来改变机体血液代谢组的组成,从而改善人类健康。
谚语“人如其食”(you are what you eat)有着近两百年的历史,如今关于这一谚语又有了新的证据,研究人员发现,肠道微生物组(包括我们喂养它们的东西)在很大程度上对不同人群机体循环的血液代谢产物的变化负责,这或许就能帮助我们设计靶向性的干预策略来改变人类血液代谢组的组成。研究者Sean Gibbons博士说道,我们知道,血液代谢组是机体血液中能与所有系统相互作用的小分子群,其在不同个体之间的差异或许会告诉我们关于机体健康和疾病状态的相关信息,而阐明指导这一变化背后的机制或许有望帮助研究人员开发改善人类健康的精准化策略。
文章中,研究人员对来自1500多名个体机体中的930种血液代谢产物进行分析,结果发现,有超过60%检测到的代谢产物都与宿主机体遗传特性或肠道微生物组之间存在明显关联;值得注意的是,69%的关联性都完全是由微生物组所驱动的,而15%的是由遗传特性驱动,16%受到了遗传学-微生物组的混合控制。研究者发现,由微生物组所解释的血液代谢产物的变化在很大程度上独立于由基因组所解释的变化,即使与遗传学和微生物都有显著关联的混合代谢产物,此外,某些代谢产物-微生物的关联性仅在拥有特定遗传背景的个体中较为显著,这或许就表明,微生物组和宿主遗传特性在塑造机体血液代谢组方面存在着非常细微的相互作用。
【8】Cell Host & Microbe:揭示肠道菌群影响小鼠机体对可卡因产生反应的分子机制
doi:10.1016/j.chom.2022.09.014
肠道菌群成员与机体多种神经心理学结果直接相关,其中就包括物质使用障碍(SUDs,substance use disorders)。近日,一篇发表在国际杂志Cell Host & Microbe上题为“Gut colonization by Proteobacteria alters host metabolism and modulates cocaine neurobehavioral responses”的研究报告中,来自威斯康星大学医学院等机构的科学家们通过研究发现,常见的肠道菌群或会增强小鼠机体中可靠因所产生的效应,相关研究结果揭示了可卡因的使用如何支持细菌的生长,从而帮助细菌摄入促进正常大脑功能的甘氨酸,随着机体甘氨酸水平的耗尽,小鼠就会表现出对药物的较高反应,以及出现行为异常,比如明显增加药物所诱导的运动和寻求行为等。
此外,通过系统性地补充甘氨酸或利用无法使用甘氨酸的遗传修饰细菌,小鼠对可卡因的反应就会回落到正常水平,这就表明,这种氨基酸实际上能在动物模型中充当成瘾样行为的调节剂。研究者Santiago Cuesta说道,我对肠脑轴非常感兴趣,其是一项非常新颖和令人兴奋的研究领域,当可卡因进入到小鼠肠道中后,其就会诱发QseC蛋白的激活,从而帮助促进诸如大肠杆菌等γ-变形菌门细菌的生长,这些细菌能在甘氨酸的驱动下超过已经存在于消化道中的正常肠道菌群,并占据大部分的空间和资源。
研究者表示,肠道菌群正在消耗所有的甘氨酸,并且甘氨酸的水平在系统中和大脑中都会下降,因此从整理上来看,改变甘氨酸的水平正在影响谷氨酸能突触(glutamatergic synapses)的功能,从而就会使得小鼠更易于发展成为成瘾性。通常情况下,对于神经科学行为而言,人们往往并不会考虑如何控制微生物群罗,而微生物的研究通常也并不会测定机体行为的改变,这项研究中,研究人员阐明了其二者之间的关联。我们机体的微生物组实际上会调节机体的精神或大脑相关的行为。
【9】Science:发现肠道细菌产生的一种新型基因毒素可导致结直肠癌风险增加
doi:10.1126/science.abm3233
近日,一篇发表在国际杂志Science上题为“Commensal microbiota from patients with inflammatory bowel disease produce genotoxic metabolites”的研究报告中,来自美国耶鲁大学的研究人员通过研究发现一组由一种肠道微生物产生的基因毒素(genotoxin)或能损害DNA,导致患结直肠癌的风险增加。在这篇论文中,他们描述了他们开发的筛选过程。
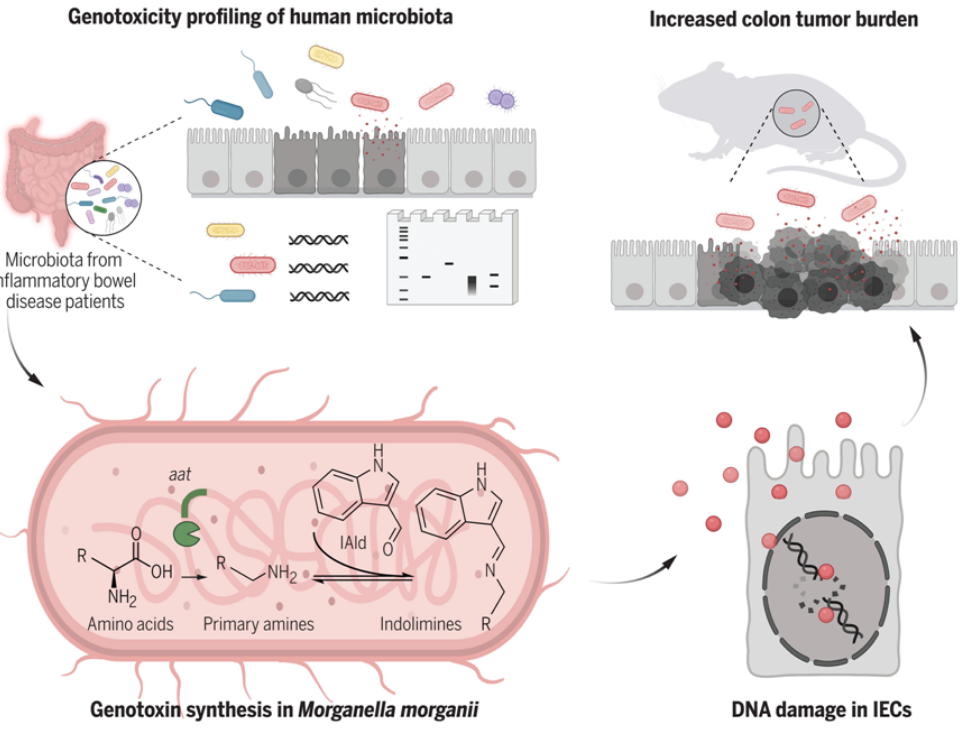
从IBD患者中分离出的人类肠道微生物会产生小分子基因毒素
图片来源:Science, 2022, doi:10.1126/science.abm3233
此前的研究已经表明,存在于人类肠道中的一些细菌可以产生导致它们的宿主大肠癌风险增加的化学物。例如,人们已发现大肠杆菌产生一种叫做大肠杆菌素(colibactin)的物质,这种物质与患癌症的几率增加有关。这类物质一般被称为基因毒素---它们通过破坏DNA而导致问题。在这项新的研究中,这些作者注意到很少有基因毒素被发现,并试图找到更多的基因毒素。
这项新的研究涉及首先收集肠易激综合征(irritable bowel syndrome, IBD)患者的粪便样本,肠易激综合征也与结直肠癌风险的增加有关。这些作者随后使用他们开发的一种方法对每个粪便样本进行筛选,以确定由特定类型的细菌产生的物质是否会在它们感染的宿主细胞中造成DNA损伤。
【10】eBioMedicine:肠道菌群或会促进机体对HIV感染的易感性
doi:10.1016/j.ebiom.2022.104286
肠道微生物组的改变或许与HIV感染有关,但在横断面研究中研究人员很难确定HIV与其它因素对机体肠道微生物组的相对影响效应。近日,一篇发表在国际杂志eBioMedicine上题为“Gut dysbiosis and inflammatory blood markers precede HIV with limited changes after early seroconversion”的研究报告中,来自加州大学洛杉矶分校等机构的科学家们通过研究发现,特定的肠道菌群(包括一种对于机体健康肠道微生物组非常重要的细菌)或许在获得性HIV感染的个体与未被感染的个体中存在一定的差异。
相关研究结果表明,肠道微生物组或许会让个体处于HIV感染的风险之中,研究者Jennifer Fulcher教授说道,这是一个需要深入研究的重要领域,其或能帮助理解是否以及这些细菌如何影响HIV的传播,基于微生物组的疗法或许正在逐渐成为一个具有巨大潜力的研究领域,随着进一步的研究,其或许有望成为一种帮助预防HIV感染和传播的新方法。众所周知,慢性HIV感染和肠道细菌改变之间存在着某种关联,于是研究人员就想通过研究深入理解当HIV感染后这些改变是何时开始发生的。
为此,他们对27名男性同性恋者进行研究,在其感染HIV之前和之后收集并分析其肠道微生物组的样本,随后将研究结果与28名有类似感染行为风险但未感染HIV的男性机体的肠道微生物组样本的研究结果进行了比较;结果表明,在第一年里,受感染男性的肠道菌群几乎并未发生改变,然而随后他们发现,相比未感染的男性而言,获得性HIV感染的男性甚至在被感染之前其机体的肠道菌群就已经存在了差异。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


