Cell:更为紧凑的靶向RNA的基因编辑工具Cas7-11S问世,有望基于此开发出新型RNA基因疗法
来源:生物谷原创 2022-06-08 09:20
在一项新的研究中,他们与东京大学的合作者合作,发现Cas7-11可以缩小到一个更紧凑的版本,使其成为编辑活细胞内RNA的一种更可行的选择。
去年,来自麻省理工学院麦戈文脑科研究所的研究人员发现了III-E型CRISPR-Cas效应蛋白Cas7-11并表征了它的特征,它是第一种能够对RNA链进行精确、有指导性的切割而在此过程中不伤害细胞的CRISPR 酶(Nature, 2021, doi:10.1038/s41586-021-03886-5)。如今,在一项新的研究中,他们与东京大学的合作者合作,发现Cas7-11可以缩小到一个更紧凑的版本,使其成为编辑活细胞内RNA的一种更可行的选择。他们描述了这种新的、紧凑的Cas7-11,同时还对原始的Cas7-11进行了详细的结构分析。
相关研究结果于2022年5月27日在线发表在Cell期刊上,论文标题为“Structure and engineering of the type III-E CRISPR-Cas7-11 effector complex”。论文通讯作者为麦戈文脑科研究所研究员Omar Abudayyeh、麦戈文脑科研究所研究员Jonathan Gootenberg和东京大学研究员Hiroshi Nishimasu。论文第一作者为麦戈文脑科研究所前博士后Nathan Zhou和东京大学的Kazuki Kato。

Abudayyeh说,“当我们观察这种结构时,很明显有一些不需要的部分,我们实际上可以去除这些部分。这使得这种酶足够小,以至于可以将它装入在单一的病毒载体中进行治疗应用。”
这些作者认为Cas7-11的新三维结构是一种丰富的资源,可以回答有关这种酶的基本生物学问题,并揭示未来调整它的功能的其他方法。
靶向RNA
在过去的十年里,CRISPR-Cas9基因组编辑技术使得科学家们有能力修改人类细胞内的基因---这对基础研究和逆转致病性基因突变的治疗方法的开发都是一大福音。但是CRISPR-Cas9只对改变DNA起作用,对于某些研究和临床目的来说,编辑RNA更为有效或有用。
细胞终生保留它的DNA,并在复制时将一个相同的DNA拷贝传递给子细胞,因此对DNA的任何改变都是相对永久性的。然而,RNA是一类更短暂的分子,由DNA转录而来,并在不久后遭受降解。
Gootenberg说,“能够永久地改变DNA有很多积极意义,特别是当涉及到治疗一种遗传性基因疾病时。但是对于感染、受伤或其他一些暂时性的疾病来说,能够通过靶向RNA来短暂地改变基因更有意义。”
在Abudayyeh、Gootenberg和他们的同事发现Cas7-11并表征它的特征之前,唯一能够靶向RNA的酶会产生混乱的副作用;当识别一种特定的基因时,这种称为Cas13的酶开始切割它周围所有的RNA。这一特性使得Cas13在诊断测试中很有效:它被用来检测某个RNA片段的存在,但对于需要有针对性切割的治疗方法来说,它却不是很有用。
Cas7-11的发现为一种更精确的RNA编辑形式打开了大门,类似于用于DNA的Cas9酶。然而,巨大的Cas7-11蛋白太大,无法装入单一的病毒载体中。
结构上的新见解
为了解析出Cas7-11的整体结构,Abudayyeh、Gootenberg和Nishimasu使用了低温电镜技术,这种技术将电子束照射在冷冻的蛋白样本上,并测量电子束的传输方式。他们知道Cas7-11采用模块化架构,由Cas7.1、Cas7.2、Cas7.3、Cas7.4、Cas11、INS和CTE这个结构域和4个结构域间接头(linker)---L1、L2、L3和L4---组成,但是并不确定这些结构域究竟是如何折叠和组装在一起的。
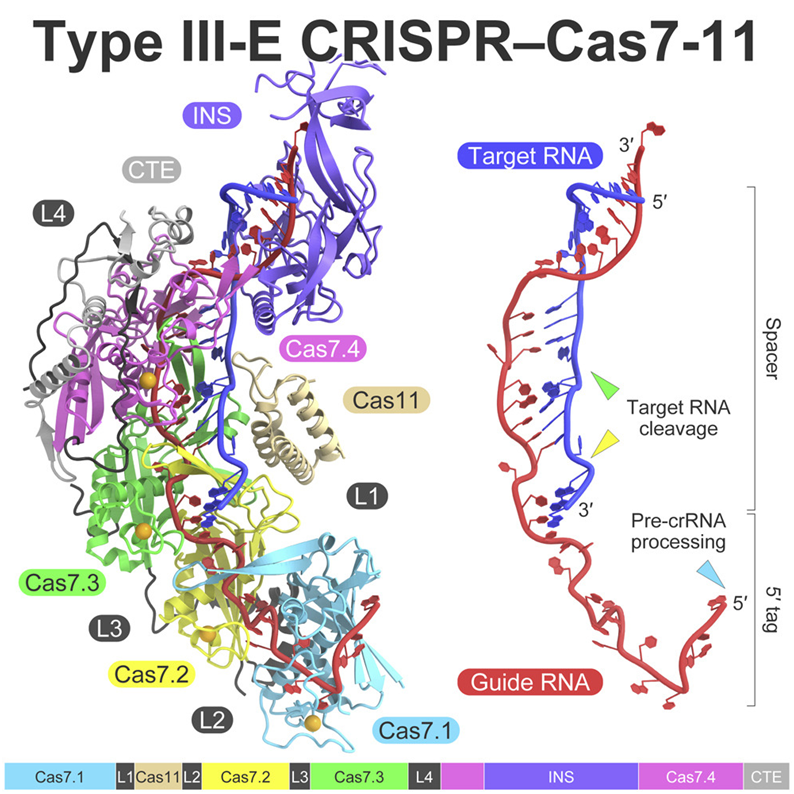
图片来自Cell, 2022, doi:10.1016/j.cell.2022.05.003。
Gootenberg说,“从基本生物学的角度来看,Cas7-11真正迷人的地方在于它应该是所有这些独立的组成部分组合在一起,但它们却融合成了一个基因。我们真的不知道为何会这样。”
Cas7-11的结构在是它结合它的目标tRNA链和指导这种结合的向导RNA(gRNA)的过程中捕捉到的,这揭示了它的这些组分部分是如何组装的,以及它的哪些组分部分对于识别和切割RNA至关重要。这种结构上的新见解对于弄清如何使Cas7-11在人体细胞内执行目标任务至关重要。
通过这种结构,这些作者发现Cas7-11通过使用Cas7.1结构域将它的前体CRISPR RNA(pre-crRNA)加工成crRNA,而且在crRNA的指导下,它还使用Cas7.2和Cas7.3结构域在两个确定的位点上切割靶RNA。该结构还揭示了Cas7-11的一个组成部分没有任何明显的功能作用。这一发现表明他们员可以将这个组成部分移除,重新设计Cas7-11,使它变得更小,而不影响它靶向RNA的能力。Abudayyeh和Gootenberg测试了去除这个组成部分的不同片段的影响,结果获得Cas7-11的一个新的紧凑版本,被称为Cas7-11S。有了Cas7-11S,他们将它装入在单个病毒载体中,将它递送到哺乳动物细胞中,并有效地靶向目标RNA。
这些作者目前正在计划未来对Cas7-11来源细菌中与它相互作用的其他蛋白进行研究,并希望继续致力于将Cas7-11用于治疗用途。
Abudayyeh说,“想象一下,你可以有一种RNA基因疗法,当进行治疗时,它可以修改你的RNA,但当你停止治疗时,这种修改就会停止。这真地只是让这组工具发挥作用的开始。” (生物谷 Bioon.com)
参考资料:
1. Kazuki Kato et al. Structure and engineering of the type III-E CRISPR-Cas7-11 effector complex. Cell, 2022, doi:10.1016/j.cell.2022.05.003.
2. Convenience-sized RNA editing
https://news.mit.edu/2022/convenience-sized-rna-editing-0531
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


