Cell:重磅!抑制外泌体PD-L1可诱导全身性的抗肿瘤免疫反应
来源:本站原创 2019-04-24 13:44
2019年4月24日讯/生物谷BIOON/---一类称为免疫检查点抑制剂的免疫治疗药物彻底改变引发了癌症治疗变革:许多直到最近还被认为无法治疗的恶性肿瘤患者正在经历长期缓解。但是,大多数患者对这类药物没有反应,而且它们对某些癌症的治疗效果要比其他癌症好得多,其中的原因令科学家们困惑不解。如今,在一项新的研究中,来自美国加州大学旧金山分校的研究人员发现了一个令人惊讶的现象,这或许可以解释为什么许多癌
2019年4月24日讯/生物谷BIOON/---一类称为免疫检查点抑制剂的免疫治疗药物彻底改变引发了癌症治疗变革:许多直到最近还被认为无法治疗的恶性肿瘤患者正在经历长期缓解。但是,大多数患者对这类药物没有反应,而且它们对某些癌症的治疗效果要比其他癌症好得多,其中的原因令科学家们困惑不解。如今,在一项新的研究中,来自美国加州大学旧金山分校的研究人员发现了一个令人惊讶的现象,这或许可以解释为什么许多癌症对这些药物没有反应,并提出了激活免疫系统对抗疾病的新策略。相关研究结果发表在2019年4月4日的Cell期刊上,论文标题为“Suppression of Exosomal PD-L1 Induces Systemic Anti-tumor Immunity and Memory”。
论文通讯作者、加州大学旧金山分校泌尿学教授Robert Blelloch博士说道,“在最好的情况下,比如对黑色素瘤而言,只有20%到30%的患者对免疫检查点抑制剂有反应,而在其他情况下,比如对前列腺癌而言,只有个位数的反应率。这意味着大多数患者没有反应。我们想知道其中的原因。”
在恶性肿瘤组织中,一种称为PD-L1的蛋白起“隐形斗篷”的作用:癌细胞通过在其表面上展示PD-L1来保护自己免受免疫系统的攻击。一些最成功的免疫治疗药物通过干扰PD-L1或它的受体PD-1---位于免疫细胞表面上---起作用。当PD-L1和PD-1之间的相互作用受到阻断时,肿瘤就会失去躲避免疫系统的能力,并且变得易受抗癌免疫攻击。
某些肿瘤可能对这类免疫疗法有抵抗力的一个原因是它们不会产生PD-L1,这意味着现有的免疫检查点抑制剂无法发挥作用---也就是说,它们可能会使用其他的迄今尚未发现的免疫检查点蛋白来避免免疫系统的识别。科学家们此前已发现PD-L1蛋白在前列腺癌患者的肿瘤细胞中以低水平或完全不存在的方式存在着,这可能解释了它们对这类免疫疗法的抵抗力。
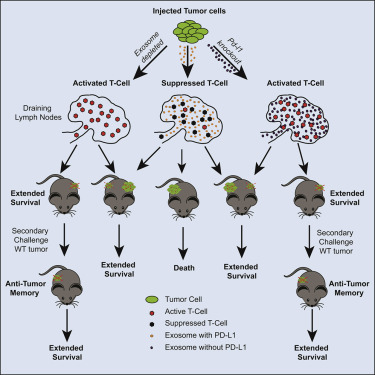
但是,在这项新的研究中,Blelloch及其团队针对这一点提出了一个非常不同的答案:他们发现PD-L1是由这些肿瘤大量生产的,不过癌细胞不是在它们的表面上展示这种蛋白,而是通过一种称为外泌体的分子货轮输出PD-L1。这些包被着PD-L1的外泌体从癌细胞上脱落下来,并通过淋巴系统或血液流到淋巴结,即免疫细胞经激活后保护身体的部位。在那里,PD-L1蛋白充当流动的分子破坏者,远程解除免疫细胞的武装,并阻止它们确定肿瘤的位置以发起抗癌攻击。
因此,外泌体携带的PD-L1(下称外泌体PD-L1)不是关闭肿瘤表面的免疫反应,而是在它们到达那里之前抑制免疫细胞。与在肿瘤表面发现的PD-L1不同的是,外泌体PD-L1由于不明原因,对现有的免疫检查点抑制剂具有抵抗性。
Blelloch说,“现有的流行看法是PD-L1作用于进入肿瘤微环境(tumor niche)中的免疫细胞,在这种肿瘤微环境中,免疫细胞会遇到这种免疫抑制蛋白。我们的数据表明,对于许多对免疫疗法产生抵抗性的肿瘤来说,情况并非如此。这些肿瘤通过将外泌体PD-L1传递到淋巴结中来躲避免疫系统,它们在淋巴结中远程抑制免疫细胞的激活。这些发现代表着对现有教条的打破。”
当注意到一些表明现有的PD-L1展示观点存在缺陷的现象时,Blelloch团队决定探究外泌体。与之前的科学家一样,他们发现免疫治疗抵抗性癌症具有较低的PD-L1蛋白水平。但是当他们研究信使RNA(mRNA)时,他们观察到了一个奇怪的不一致性:相对于他们在癌细胞中测量到的太少PD-L1蛋白,PD-L1 mRNA太多了。
Blelloch说,“我们观察到mRNA和蛋白水平之间的差异,并想知道发生了什么。我们的实验还表明PD-L1蛋白实际上是在某个时刻产生的,而且它没有被降解。这是在我们研究外泌体并发现缺失的PD-L1之时。”
外泌体PD-L1阻阻止免疫反应,促进癌症生长
为了证实外泌体PD-L1负责赋予免疫隐身性,这些研究人员采用了一种对免疫检查点抑制剂产生抵抗性的小鼠前列腺癌模型。当他们将这些癌细胞移植到健康小鼠体内时,肿瘤迅速生长。但是,当他们使用基因编辑工具CRISPR移除外泌体产生所需的两个基因时,这些经过编辑的癌细胞无法在遗传上相同的小鼠中形成肿瘤。虽然经过编辑的癌细胞和未经过编辑的细胞都产生PD-L1,但是当PD-L1被阻断时,只有那些不能产生外泌体的癌细胞对免疫系统是可见的并且易受免疫系统的影响。
论文第一作者、加州大学旧金山分校博士后研究员Mauro Poggio博士说,“这一发现的重要性是显而易见的。目前在临床上,没有可用的药物来抵消外泌体PD-L1的破坏力,因此了解外泌体PD-L1的生物学特性是为患者提供新的治疗方法的第一步。”
在另一项补充实验中,将相同的经过CRISPR编辑的癌细胞移植到健康小鼠中,然后立即注射一系列携带PD-L1的外泌体。由于无法产生外泌体,这些经过CRISPR编辑的癌细胞应当成为免疫系统的牺牲品。相反,所注射的外泌体能够代表癌症中和免疫反应,这使得这些缺乏外泌体的癌细胞形成肿瘤。
为了弄清外泌体PD-L1如何干扰免疫系统,这些研究人员检查了接受经过CRISPR编辑或未经过编辑的癌细胞移植的小鼠的淋巴结。接受经过编辑的癌细胞移植的小鼠在它们的淋巴结中表现出增加的免疫细胞增殖,并且有更多的活化免疫细胞。
在结直肠癌小鼠模型---结直肠癌仅对免疫治疗有部分反应---中,这些研究人员鉴定出两个不同的PD-L1池:一个PD-L1池位于肿瘤细胞表面,对PD-L1抑制剂敏感;另一个PD-L1池位于外泌体中,对PD-L1抑制剂产生抵抗性。当他们利用一种涉及阻止外泌体形成和给予PD-L1抑制剂的联合疗法治疗这种癌症时,相比于单独使用其中的一种方法,这些小鼠存活更长的时间。
Blelloch说,“来自这两种非常不同的癌症模型的这些数据提出了一种新的治疗方法,即抑制外泌体中的PD-L1释放,无论是单独使用还是与当前的免疫检查点抑制剂联合使用,都可能能够克服当前大部分患者对单独使用的免疫检查点抑制剂治疗产生的抵抗性。”
缺乏外泌体的肿瘤细胞可作为免疫治疗抵抗性癌症的“疫苗”
在来自这项新研究的一个令人吃惊的结果中,这些研究人员发现他们能够使用经过CRISPR编辑后缺乏外泌体的癌细胞来诱导针对通常对免疫攻击产生抵抗力的肿瘤的抗癌免疫反应。
这些研究人员首先将经过CRISPR编辑后不能产生外泌体的癌细胞移植到正常小鼠体内并等待90天。他们随后将未经过编辑的---很可能是免疫逃避的---癌细胞移植到相同老鼠体内。在将免疫系统暴露于经过CRISPR编辑后缺乏外泌体的癌细胞之后,这些未经过编辑的癌细胞不再对免疫系统是不可见的。免疫系统没有忽略这些癌细胞,而是发起了强有力的免疫反应来靶向攻击这些以前是免疫逃避的癌细胞并阻止它们增殖。
Blelloch说,“免疫系统在暴露于不能产生外泌体PD-L1的癌细胞后会形成抗肿瘤记忆。一旦免疫系统产生记忆,它就不再对这种形式的PD-L1敏感,因此也靶向攻击产生外泌体PD-L1的癌细胞。”
当将未经过CRISPR编辑的癌细胞和经过编辑后不产生外泌体的癌细胞同时移植到同一只小鼠的两个相对部位时,这些研究人员获得了另一个令人吃惊的研究结果。尽管它们同时被移植,但是这些经过CRISPR编辑的癌细胞经证实发挥主导作用---它们能够激活免疫系统,随后对在相对部位生长的因未经过编辑而应当具有免疫治疗抵抗性的肿瘤发起攻击。
这些结果表明即使暂时抑制外泌体中的PD-L1释放也可能导致长期的、全身范围的肿瘤生长抑制。此外,它们暗示了一种新的免疫疗法的可能性,在这种疗法中,对患者的癌细胞进行编辑,并将编辑后的癌细胞重新植入患者体内,以便激活免疫系统并让它攻击免疫抵抗性的癌症。抑制外泌体中的PD-L1释放或接种Blelloch团队设计的这种“肿瘤细胞疫苗”可能有一天为那些对当前治疗方案没有反应的肿瘤患者带来希望。
Poggio说,“PD-L1在癌症中的作用还有待进一步研究。我们仅是触及可能是一种新机制的皮毛。如果这种机制被阻断,那么这就有可能抑制许多目前对免疫治疗没有反应的侵袭性肿瘤。”(生物谷 Bioon.com)
参考资料:
Mauro Poggio et al. Suppression of Exosomal PD-L1 Induces Systemic Anti-tumor Immunity and Memory. Cell, 2019, doi:10.1016/j.cell.2019.02.016.

图片来自Cell, 2019, doi:10.1016/j.cell.2019.02.016。
论文通讯作者、加州大学旧金山分校泌尿学教授Robert Blelloch博士说道,“在最好的情况下,比如对黑色素瘤而言,只有20%到30%的患者对免疫检查点抑制剂有反应,而在其他情况下,比如对前列腺癌而言,只有个位数的反应率。这意味着大多数患者没有反应。我们想知道其中的原因。”
在恶性肿瘤组织中,一种称为PD-L1的蛋白起“隐形斗篷”的作用:癌细胞通过在其表面上展示PD-L1来保护自己免受免疫系统的攻击。一些最成功的免疫治疗药物通过干扰PD-L1或它的受体PD-1---位于免疫细胞表面上---起作用。当PD-L1和PD-1之间的相互作用受到阻断时,肿瘤就会失去躲避免疫系统的能力,并且变得易受抗癌免疫攻击。
某些肿瘤可能对这类免疫疗法有抵抗力的一个原因是它们不会产生PD-L1,这意味着现有的免疫检查点抑制剂无法发挥作用---也就是说,它们可能会使用其他的迄今尚未发现的免疫检查点蛋白来避免免疫系统的识别。科学家们此前已发现PD-L1蛋白在前列腺癌患者的肿瘤细胞中以低水平或完全不存在的方式存在着,这可能解释了它们对这类免疫疗法的抵抗力。
但是,在这项新的研究中,Blelloch及其团队针对这一点提出了一个非常不同的答案:他们发现PD-L1是由这些肿瘤大量生产的,不过癌细胞不是在它们的表面上展示这种蛋白,而是通过一种称为外泌体的分子货轮输出PD-L1。这些包被着PD-L1的外泌体从癌细胞上脱落下来,并通过淋巴系统或血液流到淋巴结,即免疫细胞经激活后保护身体的部位。在那里,PD-L1蛋白充当流动的分子破坏者,远程解除免疫细胞的武装,并阻止它们确定肿瘤的位置以发起抗癌攻击。
因此,外泌体携带的PD-L1(下称外泌体PD-L1)不是关闭肿瘤表面的免疫反应,而是在它们到达那里之前抑制免疫细胞。与在肿瘤表面发现的PD-L1不同的是,外泌体PD-L1由于不明原因,对现有的免疫检查点抑制剂具有抵抗性。
Blelloch说,“现有的流行看法是PD-L1作用于进入肿瘤微环境(tumor niche)中的免疫细胞,在这种肿瘤微环境中,免疫细胞会遇到这种免疫抑制蛋白。我们的数据表明,对于许多对免疫疗法产生抵抗性的肿瘤来说,情况并非如此。这些肿瘤通过将外泌体PD-L1传递到淋巴结中来躲避免疫系统,它们在淋巴结中远程抑制免疫细胞的激活。这些发现代表着对现有教条的打破。”
当注意到一些表明现有的PD-L1展示观点存在缺陷的现象时,Blelloch团队决定探究外泌体。与之前的科学家一样,他们发现免疫治疗抵抗性癌症具有较低的PD-L1蛋白水平。但是当他们研究信使RNA(mRNA)时,他们观察到了一个奇怪的不一致性:相对于他们在癌细胞中测量到的太少PD-L1蛋白,PD-L1 mRNA太多了。
Blelloch说,“我们观察到mRNA和蛋白水平之间的差异,并想知道发生了什么。我们的实验还表明PD-L1蛋白实际上是在某个时刻产生的,而且它没有被降解。这是在我们研究外泌体并发现缺失的PD-L1之时。”
外泌体PD-L1阻阻止免疫反应,促进癌症生长
为了证实外泌体PD-L1负责赋予免疫隐身性,这些研究人员采用了一种对免疫检查点抑制剂产生抵抗性的小鼠前列腺癌模型。当他们将这些癌细胞移植到健康小鼠体内时,肿瘤迅速生长。但是,当他们使用基因编辑工具CRISPR移除外泌体产生所需的两个基因时,这些经过编辑的癌细胞无法在遗传上相同的小鼠中形成肿瘤。虽然经过编辑的癌细胞和未经过编辑的细胞都产生PD-L1,但是当PD-L1被阻断时,只有那些不能产生外泌体的癌细胞对免疫系统是可见的并且易受免疫系统的影响。
论文第一作者、加州大学旧金山分校博士后研究员Mauro Poggio博士说,“这一发现的重要性是显而易见的。目前在临床上,没有可用的药物来抵消外泌体PD-L1的破坏力,因此了解外泌体PD-L1的生物学特性是为患者提供新的治疗方法的第一步。”
在另一项补充实验中,将相同的经过CRISPR编辑的癌细胞移植到健康小鼠中,然后立即注射一系列携带PD-L1的外泌体。由于无法产生外泌体,这些经过CRISPR编辑的癌细胞应当成为免疫系统的牺牲品。相反,所注射的外泌体能够代表癌症中和免疫反应,这使得这些缺乏外泌体的癌细胞形成肿瘤。
为了弄清外泌体PD-L1如何干扰免疫系统,这些研究人员检查了接受经过CRISPR编辑或未经过编辑的癌细胞移植的小鼠的淋巴结。接受经过编辑的癌细胞移植的小鼠在它们的淋巴结中表现出增加的免疫细胞增殖,并且有更多的活化免疫细胞。
在结直肠癌小鼠模型---结直肠癌仅对免疫治疗有部分反应---中,这些研究人员鉴定出两个不同的PD-L1池:一个PD-L1池位于肿瘤细胞表面,对PD-L1抑制剂敏感;另一个PD-L1池位于外泌体中,对PD-L1抑制剂产生抵抗性。当他们利用一种涉及阻止外泌体形成和给予PD-L1抑制剂的联合疗法治疗这种癌症时,相比于单独使用其中的一种方法,这些小鼠存活更长的时间。
Blelloch说,“来自这两种非常不同的癌症模型的这些数据提出了一种新的治疗方法,即抑制外泌体中的PD-L1释放,无论是单独使用还是与当前的免疫检查点抑制剂联合使用,都可能能够克服当前大部分患者对单独使用的免疫检查点抑制剂治疗产生的抵抗性。”
缺乏外泌体的肿瘤细胞可作为免疫治疗抵抗性癌症的“疫苗”
在来自这项新研究的一个令人吃惊的结果中,这些研究人员发现他们能够使用经过CRISPR编辑后缺乏外泌体的癌细胞来诱导针对通常对免疫攻击产生抵抗力的肿瘤的抗癌免疫反应。
这些研究人员首先将经过CRISPR编辑后不能产生外泌体的癌细胞移植到正常小鼠体内并等待90天。他们随后将未经过编辑的---很可能是免疫逃避的---癌细胞移植到相同老鼠体内。在将免疫系统暴露于经过CRISPR编辑后缺乏外泌体的癌细胞之后,这些未经过编辑的癌细胞不再对免疫系统是不可见的。免疫系统没有忽略这些癌细胞,而是发起了强有力的免疫反应来靶向攻击这些以前是免疫逃避的癌细胞并阻止它们增殖。
Blelloch说,“免疫系统在暴露于不能产生外泌体PD-L1的癌细胞后会形成抗肿瘤记忆。一旦免疫系统产生记忆,它就不再对这种形式的PD-L1敏感,因此也靶向攻击产生外泌体PD-L1的癌细胞。”
当将未经过CRISPR编辑的癌细胞和经过编辑后不产生外泌体的癌细胞同时移植到同一只小鼠的两个相对部位时,这些研究人员获得了另一个令人吃惊的研究结果。尽管它们同时被移植,但是这些经过CRISPR编辑的癌细胞经证实发挥主导作用---它们能够激活免疫系统,随后对在相对部位生长的因未经过编辑而应当具有免疫治疗抵抗性的肿瘤发起攻击。
这些结果表明即使暂时抑制外泌体中的PD-L1释放也可能导致长期的、全身范围的肿瘤生长抑制。此外,它们暗示了一种新的免疫疗法的可能性,在这种疗法中,对患者的癌细胞进行编辑,并将编辑后的癌细胞重新植入患者体内,以便激活免疫系统并让它攻击免疫抵抗性的癌症。抑制外泌体中的PD-L1释放或接种Blelloch团队设计的这种“肿瘤细胞疫苗”可能有一天为那些对当前治疗方案没有反应的肿瘤患者带来希望。
Poggio说,“PD-L1在癌症中的作用还有待进一步研究。我们仅是触及可能是一种新机制的皮毛。如果这种机制被阻断,那么这就有可能抑制许多目前对免疫治疗没有反应的侵袭性肿瘤。”(生物谷 Bioon.com)
参考资料:
Mauro Poggio et al. Suppression of Exosomal PD-L1 Induces Systemic Anti-tumor Immunity and Memory. Cell, 2019, doi:10.1016/j.cell.2019.02.016.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


