Science:利用mRNA递送在体内对造血干细胞进行基因编辑,有望治疗一系列血液疾病
来源:生物谷原创 2023-08-08 09:33
在一项新的研究中,来自美国费城儿童医院和宾夕法尼亚大学佩雷尔曼医学院的研究人员开发出了一种概念验证模型,用于递送基因编辑工具来治疗血液疾病,从而可以直接在体内改造患病的血细胞,这是基因药物发展的一个进
在一项新的研究中,来自美国费城儿童医院和宾夕法尼亚大学佩雷尔曼医学院的研究人员开发出了一种概念验证模型,用于递送基因编辑工具来治疗血液疾病,从而可以直接在体内改造患病的血细胞,这是基因药物发展的一个进步。如果将这种方法应用于临床,就可能扩大基因疗法治疗血液疾病的使用范围并降低成本,而目前许多血液疾病基因疗法需要患者接受化疗和干细胞移植。相关研究结果发表在2023年7月28日的Science期刊上,论文标题为“In vivo hematopoietic stem cell modification by mRNA delivery”。

论文共同通讯作者、费城儿童医院儿科教授Stefano Rivella博士说,“目前,如果你想用基因疗法治疗镰状细胞病和β地中海贫血等血液疾病,患者必须接受诸如化疗之类的调理治疗(conditioning treatments),为新的、经过基因校正的血细胞腾出空间,这既昂贵又有风险。在我们的论文中,我们证明了可以通过‘一劳永逸’的疗法,在体内直接用经过基因校正的血细胞替换病变的血细胞,从而无需进行清髓性调理治疗(myeloablative conditioning treatments),并简化了这些可能改变生命的治疗方法的递送过程。这是我们在治疗遗传疾病的思路上向前迈出的一大步,可能扩大基因疗法的使用范围,让最需要的患者也能接受基因疗法。”
论文共同通讯作者、宾夕法尼亚大学佩雷尔曼医学院传染病研究助理教授Hamideh Parhiz博士说,“向特定组织和细胞类型靶向递送mRNA编码的治疗剂将对未来用核酸治疗疾病的方式产生巨大影响。在我们的研究中,我们提供了一种细胞特异性靶向脂质纳米颗粒,它封装了作为一种平台技术的mRNA治疗剂/编辑剂,可用于针对许多需要精确靶向基因治疗方式的疾病的体内细胞重编程。在这篇论文中,我们将这种靶向平台与 mRNA 疗法和基于 RNA 的基因组编辑工具的进展相结合,提供了一种控制造血干细胞命运和校正基因缺陷的新方法。与目前可用的技术相比,mRNA编码的靶向基因组编辑方法可实现可控表达、高编辑效力和潜在更安全的体内基因组修饰。”
造血干细胞(HSC)存在于骨髓中,在骨髓中终生分裂,以便产生血液和免疫系统中的所有细胞。在镰状细胞病和免疫缺陷病等非恶性造血疾病患者中,这些血细胞因携带基因突变而无法正常发挥作用。
对于这些患者,目前有两种可能治愈的治疗方法,都涉及骨髓移植:一种是使用健康捐献者的造血干细胞进行干细胞移植,另一种是基因治疗,即在体外对患者自身的造血干细胞进行基因改造,然后再移植回体内(通常称为体外基因治疗)。
由于造血干细胞来自捐献者,前一种方法存在移植物抗宿主疾病的风险,而且这两种方法都涉及化疗或放疗的调理治疗方案,以消除患者体内患病的造血干细胞,使其做好接受新细胞的准备。这些调理治疗过程会产生严重的毒副作用,因此有必要研究毒性较低的方法。
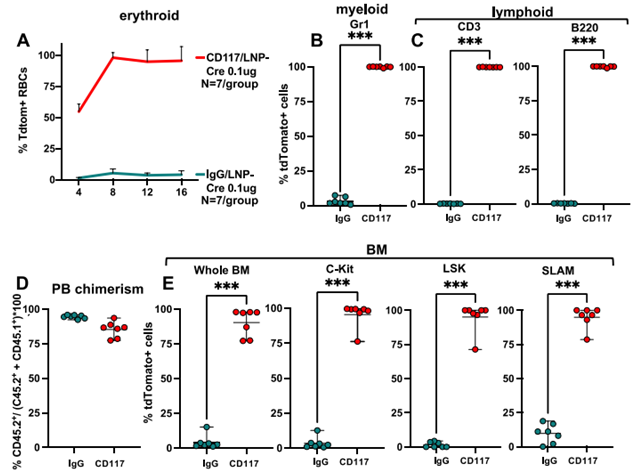
体外CD117/LNP-Cre编辑的造血干细胞在二次移植后仍然持续存在。图片来自Science, 2023, doi:10.1126/science.ade6967。
一种无需使用上述两种方法的选择是体内基因编辑:将基因编辑工具直接注入患者体内,这样就可以对造血干细胞进行编辑和校正,而无需进行调理治疗。
为了验证这种方法,费城儿童医院的Laura Breda博士和Michael P. Triebwasser博士、宾夕法尼亚大学佩雷尔曼医学院的Tyler E. Papp和mRNA 疫苗研究先驱Drew Weissman博士领导的一个研究团队使用液体纳米颗粒(liquid nanoparticle, LNP)来递送 mRNA 基因编辑工具。LNP 在包装和向细胞递送 mRNA 方面非常有效,由于 LNP-mRNA 平台用于两种COVID-19 疫苗,LNP 在 2020 年得到了广泛应用。
然而,就 COVID-19 疫苗而言,LNP-mRNA 构造物并不针对体内的特定细胞或器官。鉴于这些作者希望专门针对造血干细胞,他们给实验用 LNP 表面装饰了能识别造血干细胞表面受体 CD117 的抗体。随后,他们采用了三种方法来测试 CD117/LNP 配方的功效。
首先,这些作者测试了CD117/LNP封装的报告基因mRNA,结果显示成功实现了体内mRNA表达和基因编辑。接下来,他们研究了这种方法是否可用于治疗血液病。他们测试了CD117/LNP封装的mRNA,该mRNA编码一种针对导致镰状细胞病的基因突变的Cas9基因编辑器。这种基因编辑技术能将致病血红蛋白突变转化为非致病变体。
这些作者在镰状细胞病捐献者的造血干细胞上测试了他们的LNP-mRNA 构造物,结果显示,CD117/LNP促进了体外高效碱基编辑,使功能性血红蛋白相应增加了91.7%。他们还证明,镰状细胞几乎完全消失。
最后,这些作者探讨了 LNPs是否可用于体内调理治疗,这样就可以在不使用化疗或放疗的情况下耗尽骨髓。为此,他们使用CD117/LNP封装了编码PUMA(一种促进细胞死亡的蛋白)的mRNA。
在一系列体外和体内实验中,这些作者发现,CD117/LNP-PUMA体内靶向能有效耗竭病变的造血干细胞,从而成功输注和吸收新的骨髓细胞,即定植,而无需化疗或放疗。在动物模型中观察到的定植率与报道的使用健康供体骨髓细胞足以治愈重症联合免疫缺陷症(SCID)的定植率一致,这表明这种技术可能用于治疗重症免疫缺陷症。
Breda博士说,“这些发现可能会改变基因疗法,不仅可以在体内对细胞类型进行特异性基因修饰,而且风险极低,从而可以对造血干细胞生理学进行以前不可能进行的操作,同时还提供了一个平台,如果调整得当,可以校正许多不同的单基因疾病。这类新颖的递送系统可能有助于实现数十年来遗传学和生物医学协同研究以消除一系列人类疾病的承诺。”(生物谷 Bioon.com)
参考资料:
Laura Breda et al. In vivo hematopoietic stem cell modification by mRNA delivery. Science, 2023, doi:10.1126/science.ade6967.
Samuele Ferrari et al. A step toward stem cell engineering in vivo. Science, 2023, doi:10.1126/science.adj0997.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


