“渐冻症”新药!Albrioza获全球首个监管批准:显著改善临床功能下降,降低死亡风险!
来源:生物谷原创 2022-06-15 10:31
Albrioza是一种复方制剂,由苯丁酸钠(PB)和牛磺酸二醇(TURSO)组成,旨在靶向ALS和其他神经退行性疾病中的内质网和线粒体依赖性神经元退行性变通路,减少神经元死亡和功能障碍。

2022年06月15日讯 /生物谷BIOON/ --Amylyx制药公司致力于开发新疗法和其他神经退行性疾病。近日,该公司宣布,加拿大卫生部(Health Canada)已附条件批准Albrioza(又名AMX0035,PB-TURSO):用于治疗肌萎缩侧索硬化症(ALS,俗称“渐冻症”)。ALS是一种目前无法治愈且进展迅速的神经退行性疾病。临床数据显示,无论是作为单药治疗还是添加至ALS现有治疗方案中,与安慰剂组患者相比,Albrioza治疗组患者在功能结果方面显示出统计学意义和临床意义的改善。
此次批准,标志着Albrioza在全球范围内的首个监管批准。目前,Albrioza也正在接受美国FDA和欧盟EMA的审查。美国方面,FDA在本月初将Albrioza的审查周期延长3个月,更新后的决议目标日期为2022年9月29日,以便有更多时间来审查相关临床研究的额外分析。目前,全球3期PHOENIX试验(NCT05021536)正在美国和欧洲进行患者入组,该试验旨在为Albrioza治疗ALS提供额外的安全性和有效性数据,以进一步支持Amylyx的全球监管努力。
Albrioza(AMX0035,PB-TURSO)是一种由苯丁酸钠(sodium phenylbutrate,PB)和牛磺酸二醇(taurursodiol,TURSO,又名ursodoxicoltaurine)组成的专有口服固定剂量复方制剂。PB是一种小分子伴侣,旨在减少未折叠蛋白反应(UPR),防止因UPR导致的细胞死亡。TURSO是一种Bax抑制剂,旨在通过凋亡减少细胞死亡。PB和TURSO在固定剂量配方中联合使用,靶向肌萎缩侧索硬化症(ALS)和其他神经退行性疾病中的内质网和线粒体依赖性神经元退行性变通路,减少神经元死亡和功能障碍。
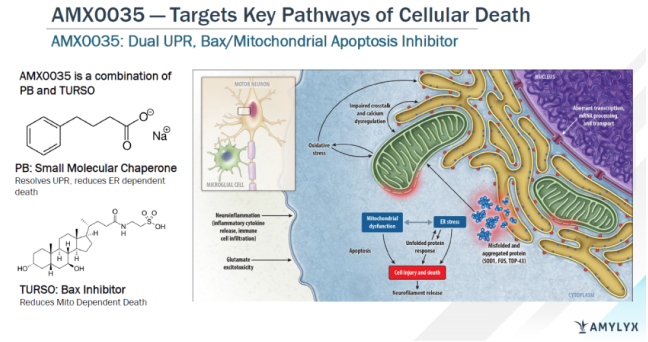
AMX0035作用机制
此次附条件批准基于2期CENTAUR试验的数据。该试验是在东北ALS联盟(NEALS)的25个临床中心开展,这是一项随机、双盲、安慰剂对照2期临床试验,评估了137名ALS成人患者,试验包括一个为期6个月的随机安慰剂对照期和一个开放标签长期随访期。
在该试验中,采用改良ALS功能评定量表(ALSFRS-R)测量,在6个月随机期结束时,与安慰剂组相比,Albrioza治疗组患者ALSFRS-R评分平均高出2.2分(29.06分 vs 26.73分),表明临床功能下降有统计学意义的显著减少。ALSFRS-R是临床实践和ALS临床试验中使用最广泛的量表。
对来自CENTAUR试验的所有随机化患者进行了长达3年随访的生存分析,包括在随访期间的开放标签扩展期继续接受Albrioza治疗的患者。分析显示,与CEUTAUR试验安慰剂对照期开始接受安慰剂治疗的患者相比,在安慰剂对照期开始接受Albrioza的患者,死亡风险降低了44%(HR=0.56;95%CI:0.34-0.92)。在开放标签长期随访期,Albrioza组的中位生存期为25.0个月(95%CI:19.0-33.6个月),安慰剂组为18.5个月(95%CI:13.5-23.2个月),差异为6.5个月。
总的来说,在24周随机期内,Albrioza组和安慰剂组的不良事件和停药报告率相似;然而,胃肠道事件发生率在Albrioza组更高(≥2%)。CENTAUR试验的详细数据已发表在《新英格兰医学杂志》(NEJM)和《肌肉与神经杂志》(Muscle and Nerve)。
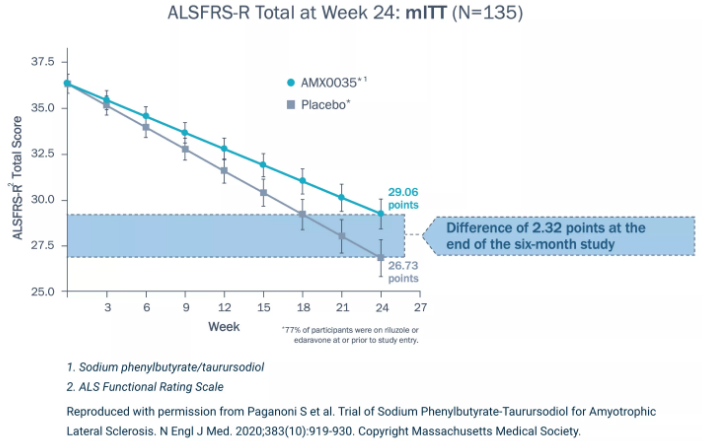
CENTAUR试验6个月安慰剂对照期数据
肌萎缩侧索硬化症(amyotrophic lateral sclerosis,简称ALS),俗称“渐冻症”,这是一种不可逆的致死性运动神经元病,主要症状为四肢和躯干肌肉表现进行性加重的肌肉无力和萎缩,逐渐失去运动功能,像被“冻住”一般,所以俗称“渐冻人”。该病一般进展迅速,半数以上患者确诊后平均生存时间为3-5年,最后多死于呼吸肌无力导致的呼吸衰竭。据估计,ALS在全球范围内的发病率约为十万分之二。尽管大约5%-10%的病例与遗传有关,但ALS的病因至今不明,可能涉及遗传和环境因素。目前已上市的药物仅能延缓病情进展,还没有能够治愈ALS的药物。
今年5月,美国FDA批准三菱田边制药Radicava ORS(edaravone,依达拉奉,口服混悬剂),用于治疗ALS。Radicava ORS专为ALS患者群体开发,将提供灵活的给药选择(口服或通过喂食管服用),无需调整剂量。Radicava ORS与Radicava(依达拉奉注射液)具有相同的活性药物成分和相同的疗效,后者是美国FDA在2017年5月批准上市的静脉注射(IV)疗法,在关键临床试验中被证实可帮助减缓ALS患者身体功能丧失。
截至目前,美国FDA已批准6款药物治疗ALS,除了Albrioza之外,有3款为不同剂型的利鲁唑产品【Exservan(利鲁唑口腔膜剂)、Rilutek(利鲁唑片剂)、Tiglutik(利鲁唑混悬剂)】,另2款为不同剂型的依达拉奉产品【Radicava(edaravone,依达拉奉静脉注射液)、Radicava ORS(依达拉奉口服混悬液)】。
利鲁唑(riluzole)被认为可以通过降低谷氨酸水平来减少运动神经元的损伤,谷氨酸是一种兴奋性神经递质,在神经细胞和运动神经元之间传递信息。依达拉奉(edaravone)是一种自由基清除剂,被认为能够缓解氧化应激的影响,而这可能是ALS发病和病情发展的关键因素。依达拉奉的抗氧化作用被认为能够为神经系统提供神经保护性支持,潜在延缓疾病发展或限制额外伤害。(生物谷Bioon.com)
原文出处:Amylyx Pharmaceuticals Announces Health Canada Approval of ALBRIOZA™ for the Treatment of ALS
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


