2023年9月Cell期刊精华
来源:生物谷原创 2023-09-29 11:45
2023年9月份即将结束,9月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2023年9月份即将结束,9月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:借助于噬菌体辅助进化和蛋白质工程,华裔科学家构建出更紧凑更高效的新型先导编辑器
doi:10.1016/j.cell.2023.07.039
先导编辑(prime editing)技术使得科学家们能够以多种方式精确编辑基因组,有朝一日可用于治疗遗传疾病。如今,在一项新的研究中,来自美国布罗德研究所的研究人员利用最先进的实验室连续进化和工程方法,开发出了这种基因编辑工具的改进版本。相关研究结果发表在2023年8月31日的Cell期刊上,论文标题为“Phage-assisted evolution and protein engineering yield compact, efficient prime editors”。
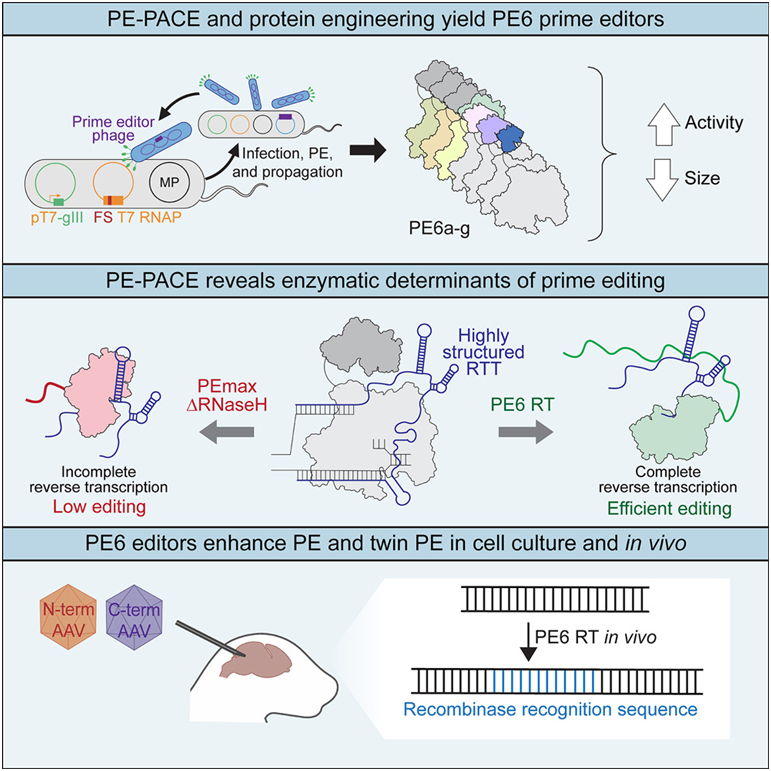
图片来自Cell, 2023, doi:10.1016/j.cell.2023.07.039。
与以前的版本相比,他们的新编辑器更高效、更专业,能够修饰体外细胞培养物中和动物体内难以编辑的DNA,包括免疫系统细胞和大脑内部的DNA。这种编辑器的体积也更小,可能更容易将它们递送到身体关键部位的细胞中,作为新的疾病治疗手段。
先导编辑可以对DNA进行有针对性的插入、删除和其他更改,该技术由布罗德研究所梅金医疗保健变革技术研究所主任David Liu教授及其团队于2019年首次描述。该技术结合了多种分子机器:一种功能失效但可以在DNA上产生切口的Cas9蛋白;一种用于工程化的先导编辑向导RNA(prime editing guide RNA, pegRNA),既能指定编辑的位置,又包含插入在该位置的新遗传指令;以及一种称为逆转录酶(reverse transcriptase)的工程化酶,它以该RNA为模板,对DNA进行特定的改变。
过去,布罗德研究所的研究人员曾对 pegRNA 和细胞对先导编辑的反应方式进行过优化,以提高编辑效率。在这项新的研究中,他们重点改进了这种先导编辑系统的核心---逆转录酶。他们构建出一系列新的先导编辑器,每一种都是在实验室中进化而来,专门从事不同的编辑任务。他们公布了其中的被命名为PE6a至PE6g的先导编辑系统,每种系统都包含一种新的逆转录酶或Cas9变体。
这些新的先导编辑器比以前的先导编辑器效率要高出2到20倍,使得它们有可能成为更有用的治疗药物。这些作者已将 PE6 编辑器用于他们几乎所有的先导编辑项目中,对多种细胞类型进行编辑,包括动物和治疗相关的培养细胞。
2.Cell:新研究阐明生活在较大细菌表面上的微小细菌的不寻常生活方式之谜
doi:10.1016/j.cell.2023.08.017
髌骨菌(Patescibacteria)是一类令人费解的微小微生物,其生存方式一直难以捉摸。科学家只能培养出几种类型的髌骨菌,但这些细菌种类繁多,存在于许多环境中。
科学家们能够在实验室中培养的少数几种髌骨菌生长在另一种更大的宿主微生物的细胞表面上。一般来说,髌骨菌缺乏制造许多生命生存所必需的分子的基因,比如构成蛋白的氨基酸、构成膜的脂肪酸和 DNA 中的核苷酸。人们由此推测,许多髌骨菌依靠其他细菌生长。
在一项新的研究中,来自美国华盛顿大学和西雅图系统生物学研究所等研究机构的研究人员首次揭示了不同寻常的髌骨菌生活方式背后的分子机制。这一突破之所以成为可能,是因为发现了一种从基因上操纵这些细菌的方法,一进展为可能的新研究方向开辟了一片天地。相关研究结果于2023年9月7日在线发表在Cell期刊上,论文标题为“Genetic manipulation of Patescibacteria provides mechanistic insights into microbial dark matter and the epibiotic lifestyle”。论文通讯作者为华盛顿大学医学院微生物学系教授Joseph Mougous博士。
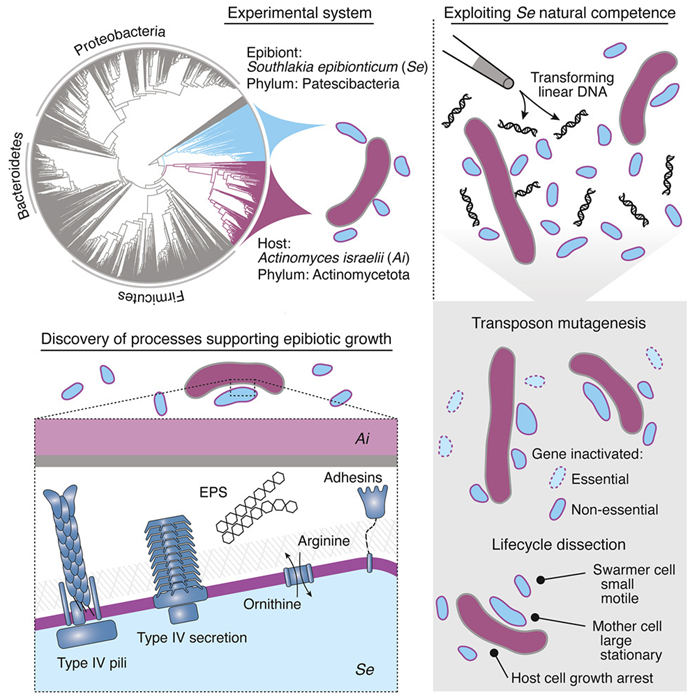
图片来自Cell, 2023, doi:10.1016/j.cell.2023.08.017。
论文共同作者、西雅图系统生物学研究所Nitin S. Baliga说,“虽然宏基因组学可以告诉我们哪些微生物生活在我们的身体上和身体内,但仅凭DNA序列并不能让我们深入了解它们的有益或有害活动,特别是对于那些以前从未表征过的生物。”他补充说,“从基因上扰乱髌骨菌的能力为应用强大的系统分析透镜来快速描述专性附生生物(obligate epibiont)的独特生物学特性提供了可能性”。专性附生生物指的是必须依附于另一种生物才能生存的生物。
这些作者对髌骨菌感兴趣有几个原因。它们是许多不为人知的细菌之一,其 DNA 序列出现在对从环境来源的物种丰富的微生物群落中发现的基因组进行的大规模遗传分析中。这种遗传物质被称为“微生物暗物质”,因为人们对其编码的功能知之甚少。
这篇论文指出,微生物暗物质可能包含具有潜在生物技术应用的生化途径信息。它还为支持微生物生态系统的分子活动以及该系统中聚集的各种微生物物种的细胞生物学提供了线索。
doi:10.1016/j.cell.2023.07.034
自然杀伤性细胞(NK cells)在机体抵御肿瘤进展的先天性免疫反应中扮演着不可或缺的角色,近日,一篇发表在国际杂志Cell上题为“A pan-cancer single-cell panorama of human natural killer cells”的研究报告中,来自北京大学等机构的科学家们通过研究解析了NK细胞在多种不同癌症类型和组织中的异质性,并发现了一类具有异常抗肿瘤功能的NK细胞亚型,其能在肿瘤微环境中特异性地生长。
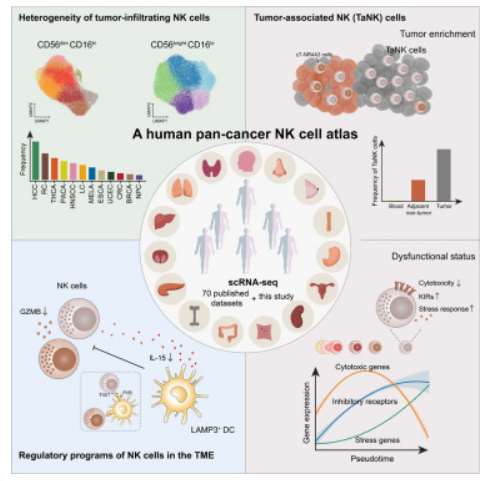
科学家识别出异常的自然杀伤性细胞亚型。图片来源:Cell (2023). DOI:10.1016/j.cell.2023.07.034
NK细胞因能直接杀死癌细胞而得名,如今其已经成为了免疫疗法的有力竞争者,并在血液癌症疗法中展现出了非凡的疗效,然而,NK细胞在不同组织微环境中的表型和功能各不相同,其异质性也给其在实体瘤疗法中的应用带来了一定的挑战。多年以来,研究者Tian教授等人一直在研究不同组织中NK细胞的异质性,这项研究中,他们收集了一个广泛的单细胞转录组数据集,其中涵盖24种癌症类型,包括来自716名患者和47名健康个体共1223份肿瘤样本。
研究人员首次在全面泛癌水平上识别出了CD56brightCD16lo NK细胞的5个不同亚型和CD56dimCD16hi NK细胞的9个亚型,同时对这些亚型的表型和功能多样性进行了细致地分析。通过整合这一广泛的数据集,研究人员观察到了不同的癌症类型中NK细胞亚型组成的偏好情况,值得注意的是,NK细胞亚型在肿瘤中、临近组织和外周血液中的分布表现出了明显的差异。利用先进的生物信息学技术,研究人员发现,RGS1基因在非血液NK细胞中会高度表达,在转录水平上,相比传统的组织残留标志物而言,RGS1表现出了显著的特异性和灵敏度。
通过探究肿瘤微环境,研究人员发现,DNAJB1+CD56dimCD16hi NK细胞在肿瘤中往往会高度富集,对这一群体进行分析表明,其表型功能失调,细胞毒性会发生降低,同时抑制性受体增加了,压力相关的蛋白水平也提高了。这种名为肿瘤相关NK细胞(TaNK cells,Tumor-associated NK cells)的亚型打破了科学家们对NK细胞丰度越高对肿瘤患者也有益的传统认知,相反,TaNK细胞与多种癌症类型患者的不良预后及对免疫疗法存在明显的抵抗力之间存在着密切关联。此外,他们还发现,LAMP3+树突状细胞(DCs)是NK细胞功能的关键调节因子,空间分布数据分析结果表明,靠近LAMP3+ DCs的NK细胞的细胞毒性活性会下降,这一观察性的研究结果表明,LAMP3+ DCs或许会对肿瘤微环境中的NK细胞功能产生异常的调节性效应。
4.Cell:开发出一种类似乐高积木的基因编辑工具---ModPoKI,有望改善CAR-T细胞疗法
doi:10.1016/j.cell.2023.08.013
近年来,科学家们利用基因修饰技术将免疫细胞重编程为可以攻击癌症的疗法。但这类免疫疗法并非对所有患者或所有癌症类型都有效,而且筛选每一种可能改善这些经过重编程的免疫细胞的基因变化组合是一项艰巨而缓慢的任务。

图片来自Cell, 2023, doi:10.1016/j.cell.2023.08.013。
如今,在一项新的研究中,来自美国格拉斯通研究所和加州大学旧金山分校的研究人员开发出了一种技术,能让他们快速“拼接”出数千种不同的基因编辑组合,以便在免疫细胞中进行测试。他们利用这项名为“模块化集合基因敲除筛选(Modular Pooled Knockin Screening, ModPoKI)”的筛选技术,确定了一种新的基因组合,当将这种基因组合加入免疫细胞后,能使这些细胞的寿命更长,抗癌效果更好。相关研究结果发表在2023年9月14日的Cell期刊上,论文标题为“Modular pooled discovery of synthetic knockin sequences to program durable cell therapies”。
论文共同通讯作者、格拉斯通-加州大学旧金山分校基因组免疫学研究所主任Alexander Marson博士说,“这是我们向前迈出的重要一步,我们有能力提出关于如何将基因程序的片段组合到细胞中并测试它们如何对患者有利的问题。我认为这将加速开发更好的细胞疗法。”
论文共同作者、斯坦福大学医学院病理学系助理教授Ansuman Satpathy博士补充说,“这项新的研究展示了利用高通量基因组学发现和设计细胞疗法中新型分子程序的能力,并进一步了解了这些程序对杀死癌症所需的T细胞状态的影响。”
5.Cell:我国科学家揭示人类巨噬细胞在产前发育过程中的分化动态变化
doi:10.1016/j.cell.2023.08.019
在一项新的研究中,来自中国科学院深圳先进技术研究院、暨南大学、深圳大学、复旦大学、厦门大学和以色列魏茨曼科学研究所等研究机构的研究人员揭示了人类巨噬细胞从早期胚胎阶段开始在19种不同组织中的分化动态变化。相关研究结果于2023年9月12日在线发表在Cell期刊上,论文标题为“An immune cell atlas reveals the dynamics of human macrophage specification during prenatal development”。
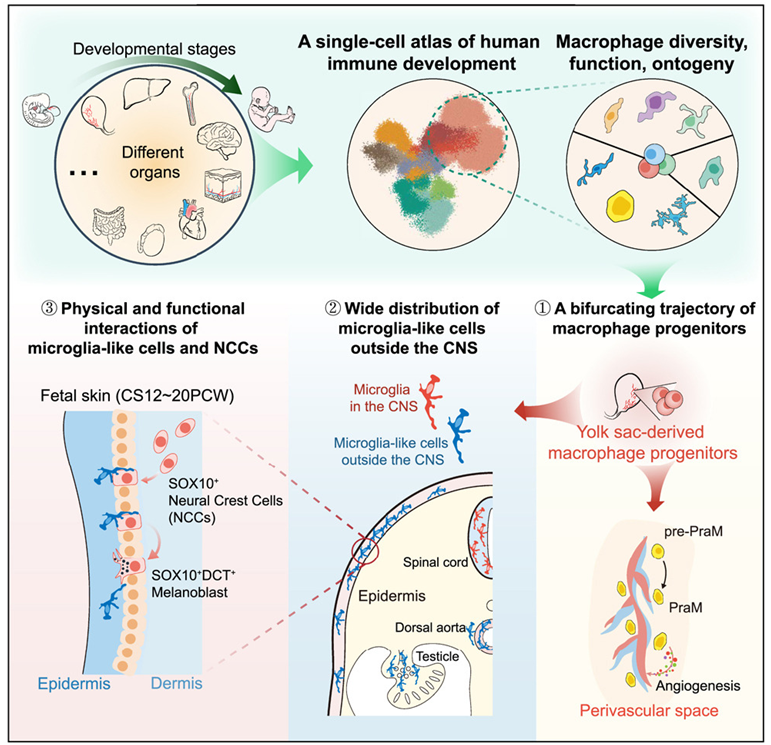
图片来自Cell, 2023, doi:10.1016/j.cell.2023.08.019。
在这项新的研究中,这些作者结合单细胞转录组测序、生物信息学技术、免疫荧光和体外功能测试,构建了人类产前免疫系统发育的高分辨率时空动态图谱,横跨18个孕期(受孕后第4周至第26周)和19种组织。
基于这种图谱,这些作者重点研究了最具组织特异性的细胞谱系---巨噬细胞。他们揭示了多种巨噬细胞亚型在发育过程中的分化起源、空间定位、功能特征和转录调控机制。
论文共同通讯作者、中国科学院深圳先进技术研究院的李汉杰教授(Li Hanjie)说,“我们研究的主要发现是确定了15种不同的巨噬细胞亚型,其中特别关注两种新的巨噬细胞群体:小胶质细胞样细胞和促血管生成巨噬细胞(proangiogenic macrophage, PraM)。”
令人惊讶的是,在胎儿表皮、睾丸和心脏等意想不到的部位发现了小胶质细胞样细胞,它们类似中枢神经系统的小胶质细胞。这些作者发现,这些细胞会影响神经嵴细胞(neural crest cell)的分化,从而促进早期组织的发育。
6.Cell:来自不可培养细菌的抗生素Clovibactin有望高效攻击有害细菌,同时不会触发细菌耐药性产生
doi:10.1016/j.cell.2023.07.038
在一项新的研究中,来自荷兰乌特勒支大学、德国波恩大学、德国感染研究中心、美国东北大学和 NovoBiotic 制药公司的研究人员发现一种从以前无法研究的细菌中分离出来的新型强效抗生素似乎能够对付有害细菌,甚至是具有多重耐药性的“超级细菌”。这种抗生素被命名为 Clovibactin,能够以一种不同寻常的方式杀死细菌,使细菌更难产生耐药性。相关研究结果发表在2023年9月14日的Cell期刊上,论文标题为“An antibiotic from an uncultured bacterium binds to an immutable target”。
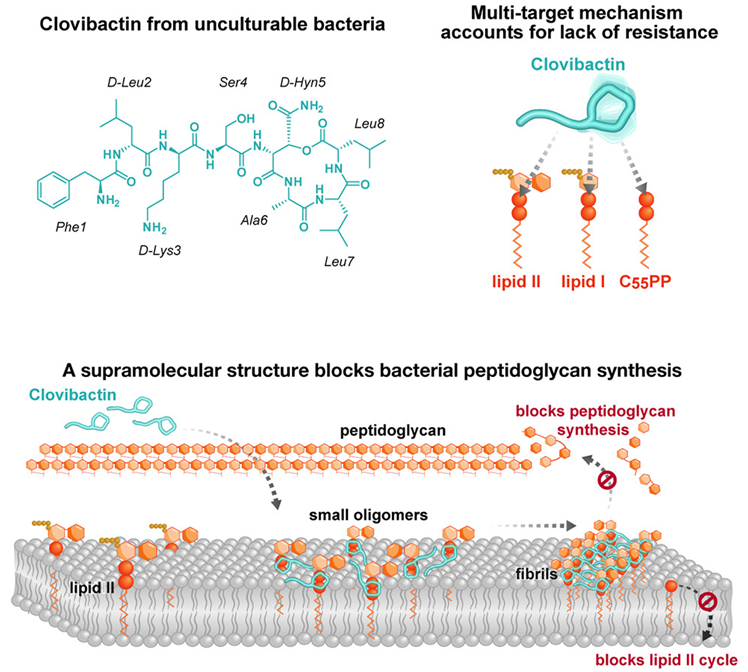
图片来自Cell, 2023, doi:10.1016/j.cell.2023.07.038。
抗生素耐药性是人类健康面临的一个重大问题,全世界的科学家们都在寻找新的解决方案。论文共同通讯作者、乌特勒支大学化学系研究员 Markus Weingarth 博士说,“我们迫切需要新的抗生素来对付对大多数临床使用的抗生素产生越来越强耐药性的细菌。”Weingarth说,“Clovibactin与众不同。由于 Clovibactin是从以前无法生长的细菌中分离出来的,致病细菌以前没有见过这种抗生素,没有时间产生耐药性。”
Clovibactin杀菌机制的显著特点是,它只与细胞壁前体分子中常见的不可改变的焦磷酸结合,却忽略了靶标中可变的糖肽部分。“由于 Clovibactin 只与靶标中不变的、保守的部分结合,细菌将更难对它产生耐药性。事实上,我们在这项新研究中没有观察到任何针对 Clovibactin 的耐药性。”
7.Cell:开发出一种研究细胞中 RNA的新系统---COURIER
doi:10.1016/j.cell.2023.06.013
RNA 分子是制造细胞用于实现各种功能的蛋白的指令,可以为了解细胞内部的情况提供精确的线索。然而,目前最先进的 RNA 检测技术需要杀死细胞:将细胞破开,以收集和分析细胞内的所有分子。这意味着科学家们只能捕捉到细胞死亡前一瞬间的状态快照,而无法观察它如何随着时间的推移而发生变化。“读取”细胞中的 RNA 是研究生物过程的有效方法,但是实际上在细胞内修补或“编写”RNA则是影响细胞行为从而治疗疾病的有力工具。比如,几种COVID-19 疫苗通过将信使RNA(mRNA)送入细胞,从而诱导产生针对冠状病毒SARS-CoV-2的抗体。RNA 可能是治疗多种疾病的有效手段,但将它递送到合适的细胞中一直是个挑战。
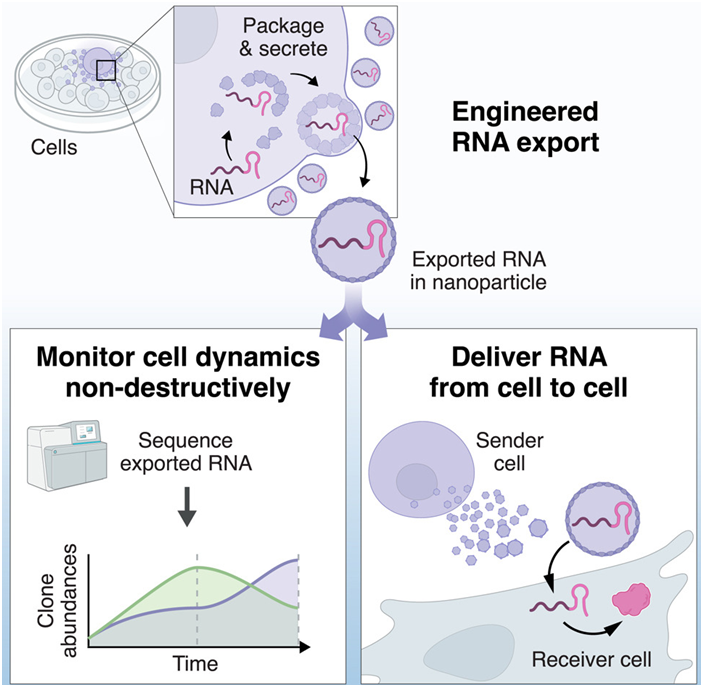
图片来自Cell, 2023, doi:10.1016/j.cell.2023.06.013。
如今,在一项新的研究中,来自美国加州理工学院的研究人员开发出了一种系统,可以同时解决“读取”和“编写”RNA的难题。这种新技术允许科学家们在不破坏细胞的情况下长期研究细胞中的 RNA,为跟踪从胚胎发育到癌症的无数细胞过程提供了一种新方法。值得注意的是,这种系统还能对细胞进行编辑以便将RNA递送到其他细胞中,从而开辟了以特定方式设计细胞行为的可能性,并有可能实现新的治疗策略。相关研究结果发表在2023年8月17日的Cell期刊上,论文标题为“Engineering RNA export for measurement and manipulation of living cells”。
论文第一作者兼论文共同通讯作者、加州理工学院博士后学者Felix Horns说,“生物学中有许多过程,我们想知道细胞在这些过程中是如何随时间发生变化的。比如,在发育过程中,胚胎通过改变细胞状态发育成许多不同的组织。癌症等许多疾病都是随着时间的推移而发生变化的,当然,衰老也是随着时间的推移而发生变化的。”
Horns补充道,“RNA 的核心作用是告诉细胞该做什么。如果我们能测量细胞表达的 RNA,就能了解细胞在做什么。此外,正如我们过去几年中在RNA 疫苗形式中观察到的情形,我们可以通过递送 mRNA 给细胞下达指令,并对细胞的行为进行编程。”
论文共同通讯作者加州理工学院生物学与生物工程学教授Michael Elowitz说,“令人惊叹的是,同一种分子设备---我们的 RNA 输出系统(RNA export system)---解决了读取和控制这两个看似独立的难题。”
这一新系统被命名为COURIER(Controlled Output and Uptake of RNA for Interrogation, Expression, and Regulation),能够从细胞中输出RNA。有了COURIER,人们就可以通过基因工程改造细胞,让它把自己的一些RNA包装在自我组装的蛋白小容器中,然后用膜包围的囊泡把它“运出”,或者说分泌。
8.Cell:我国科学家领衔发现从一名患者体内分离出的新型禽流感病毒H3N8可通过飞沫在动物间传播
doi:10.1016/j.cell.2023.08.011
在一项新的研究中,来自中国农业大学、中国科学院、中国疾病预防控制中心和英国诺丁汉大学的研究人员发现在中国家禽养殖场流行的一种禽流感病毒亚型正在发生变异,这可能会增加这种病毒传染给人类的风险。这一发现令人担忧潜在的流行病或大流行正在酝酿之中,因此有必要开展协同研究,密切监测家禽和人类体内的此类病毒。相关研究结果于2023年9月4日在线发表在Cell期刊上,论文标题为“Airborne transmission of human-isolated avian H3N8 influenza virus between ferrets”。论文通讯作者为中国农业大学动物医学院的刘金华(Jinhua Liu)教授和中国科学院的高福(George F. Gao)院士。论文第一作者为中国农业大学的Honglei Sun、Han Li、Qi Tong、Qiqi Han和Jiyu Liu。

图片来自Cell, 2023, doi:10.1016/j.cell.2023.08.011。
这些作者报告了从一名人类患者身上分离出的禽流感病毒亚型H3N8的特征。通过研究以实验室小鼠和雪貂作为人类感染的模型,他们发现H3N8经历了几种适应性变化,导致严重的动物感染,并使得它可通过空气在动物间传播。
在人类中,H3N8感染可导致急性呼吸窘迫综合征,甚至致命。这种病毒在鸡群中广泛存在,但此前人们对它如何从动物传染给人类的特征知之甚少。
这些作者证实从一名重症肺炎患者身上分离出的禽流感病毒 H3N8能在人类支气管细胞和肺上皮细胞中高效复制,对实验室哺乳动物宿主的影响极为有害,而且可以通过呼吸飞沫传播。
重要的是,他们发现该病毒获得了人类受体结合偏好和氨基酸替换 PB2-E627K,这是空气传播所必需的。即使接种了人类 H3N2 病毒疫苗,人类对新出现的适应哺乳动物的 H3N8 禽流感病毒的免疫能力似乎也很弱,并且可能容易出现流行病或大流行规模的感染。
9.Cell:利用微小的海洋生物扁盘动物有助揭示神经元的古老起源
doi:10.1016/j.cell.2023.08.027
在一项新的研究中,来自西班牙巴塞罗那基因组调控中心的研究人员通过着重关注一类毫米大小的海洋动物---扁盘动物(placozoans),为神经元的进化提供了新的线索。他们发现有证据表明,在这些独特而古老的动物体内发现的特化分泌细胞可能孕育了更复杂动物体内的神经元。相关研究结果于2023年9月19日在线发表在Cell期刊上,论文标题为“Stepwise emergence of the neuronal gene expression program in early animal evolution”。

图片来自Cell, 2023, doi:10.1016/j.cell.2023.08.027。
这些作者首先绘制了所有不同扁盘动物细胞类型的图谱,标注了它们在四个不同物种中的特征。每种细胞类型都有特定的作用,这些作用来自于特定的基因组。这种细胞图谱使得人们能够绘制出这些基因的集群或“模块”。他们随后绘制了控制这些基因模块的 DNA 调控区图谱,从而清楚地了解了每种细胞类型的作用以及它们如何协同发挥作用。最后,他们进行了跨物种比较,以重建这些细胞类型的进化过程。
这些研究结果表明扁盘动物中的九种主要细胞类型似乎是由许多“中间”细胞类型连接起来的,它们从一种类型转变为另一种类型。这些细胞不断生长和分裂,维持着这些动物移动和进食所需的细胞类型的微妙平衡。这些作者还发现了 14 种不同类型的多肽能细胞,但这些细胞与所有其他细胞都不同,没有显示出中间细胞类型,也没有任何生长或分裂的迹象。
令人惊讶的是,这些多肽能细胞与神经元有许多相似之处,而神经元直到数百万年后才出现在更高级的动物中,比如两侧对称动物。跨物种分析表明,这些相似之处是扁盘动物所独有的,并没有出现在海绵或栉水母等其他早期分支动物身上。
10.Cell:DDM1对组蛋白H3变体的染色质重塑可实现植物DNA甲基化的跨代表观遗传
doi:10.1016/j.cell.2023.08.001
当有机体将它们的基因传给后代时,它们传递的不仅仅是 DNA 中的代码。有些有机体还会传递化学标记来指示细胞如何使用这些代码。将这些化学标记传递给后代被称为表观遗传(epigenetic inheritance)。这在植物中尤为常见。因此,这个领域的重大发现可能会对农业、食品供应和环境产生影响。
在一项新的研究中,美国冷泉港实验室的Rob Martienssen教授和Leemor Joshua-Tor教授研究了植物如何传递使转座子保持在非活性状态的化学标记。转座子也被称为跳跃基因。当处于活性状态时,它们可以四处移动并破坏其他基因。为了抑制转座子并保护基因组,细胞会在特定的 DNA 位点上添加调控标记。这一过程被称为甲基化。相关研究结果发表在2023年9月14日的Cell期刊上,论文标题为“Chromatin remodeling of histone H3 variants by DDM1 underlies epigenetic inheritance of DNA methylation”。
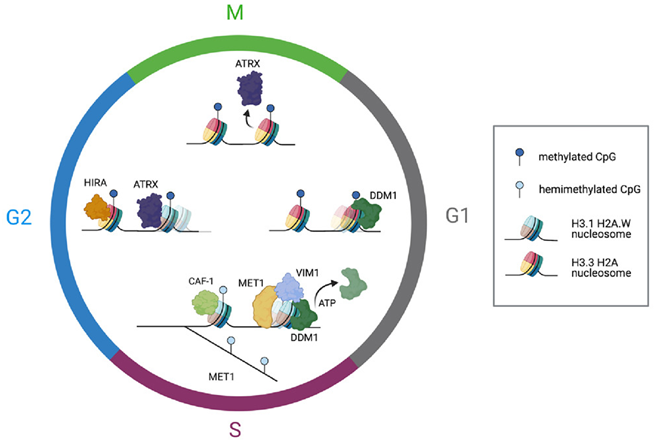
图片来自Cell, 2023, doi:10.1016/j.cell.2023.08.001。
Martienssen 和 Joshua-Tor 如今展示了蛋白DDM1 如何为在新 DNA 链上添加这些标记的酶让路。植物细胞需要 DDM1,因为它们的 DNA 被紧密包裹。为了保持基因组紧凑有序,细胞会将 DNA 包裹在称为组蛋白的包装蛋白的周围。Martienssen解释说,“但这阻碍了各种重要酶进入DNA。”在甲基化发生之前,“你必须移除或滑动组蛋白,使其不碍事”。
通过遗传和生化实验,这些作者发现DDM1 能促进组蛋白H3.3 被 组蛋白H3.1 代替。在 ddm1 突变体中,DNA 甲基化因 H3.3伴侣蛋白 HIRA 的缺失而部分恢复,而 H3.1伴侣蛋白CAF-1 则变得至关重要。利用单颗粒低温电镜,他们揭示DDM1与组蛋白 H3.3 在组装成核小体所需的氨基酸残基附近结合,并且与未修饰的组蛋白H4尾巴结合。DDM1 的N末端自体抑制结构域抑制这种酶自身的活性,而它的螺旋酶结构域中的二硫键支持它的活性。在细胞周期中,DDM1 与 H3.1 和 H3.3 以及 DNA 甲基转移酶 MET1Dnmt1 共同定位,但被 H4K16 乙酰化阻断。Joshua-Tor说,“将DDM1联系在一起的一个意想不到的键竟然与多年前发现的第一个突变相对应。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


