礼来Donanemab生死局:11:0全票通过,支持获益大于风险
来源:医药魔方 2024-06-14 09:50
Donanemab是礼来开发的一款新一代Aβ单抗,可与β淀粉样蛋白亚型N3pG结合,从而促进患者大脑中淀粉样蛋白斑块的清除。
6月10日,FDA外周和中枢神经系统药物咨询委员会(PCNS)就Donanemab用于治疗早期症状性阿尔茨海默病(AD)的生物制品许可申请(BLA)召开的会议结果出炉,委员会以11:0的票数一致赞同该药物的有效性,并一致赞同其获益大于风险。
Donanemab是礼来开发的一款新一代Aβ单抗,可与β淀粉样蛋白亚型N3pG结合,从而促进患者大脑中淀粉样蛋白斑块的清除。

来源:PCNS会议礼来PPT
礼来曾在2021年10月基于II期TRAILBLAZER-ALZ研究的数据递交该药物的上市申请,但该申请在2023年1月被FDA拒绝批准。时隔4个月,在顺利完成III期TRAILBLAZER-ALZ 2研究后,礼来再次向FDA递交了Donanemab的上市申请。FDA本应在今年第一季度对该申请作出审批决定,但决定召开委员会会议讨论Donanemab的几个关键问题,因此推迟了审批时间。
▌TRAILBLAZER-ALZ 2研究疗效数据
具体而言,在总体人群(n=1736)中,与安慰剂组相比,Donanemab组患者的AD综合评定量表(iADRS,评估患者的认知能力和生活自理能力)评分和临床痴呆评定量表(CDR-SB,评估患者的认知能力)评分的下降速度分别减缓了22%和29%。
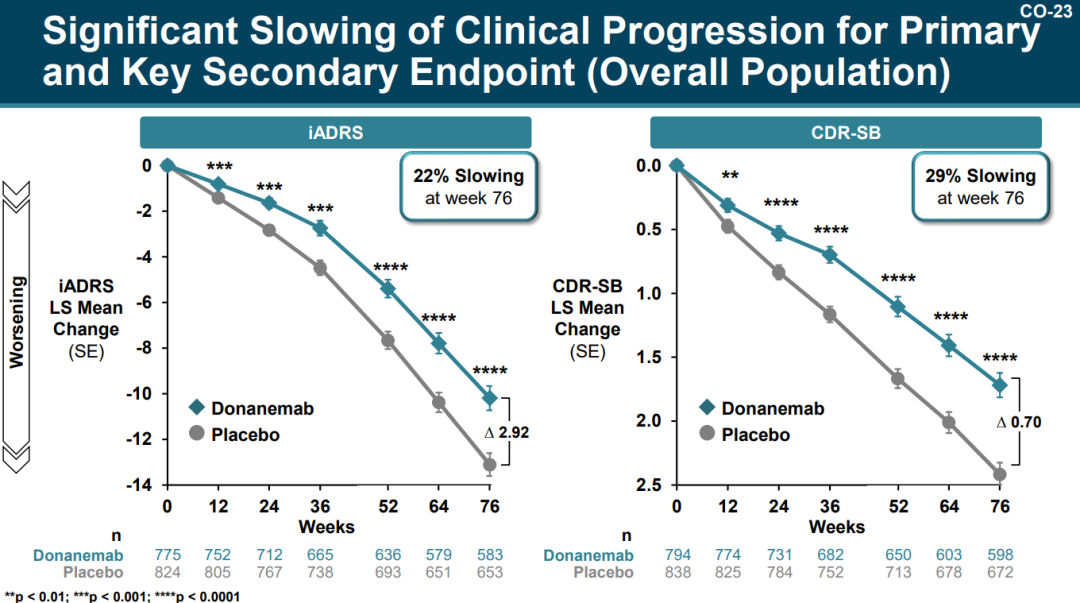
来源:PCNS会议礼来PPT
在主要分析人群(低/中tau蛋白水平,n=1182)中,Donanemab组患者的iADRS评分和CDR-SB评分的下降速度分别减缓了35%和36%;并且近一半受试者(47%)在1年内没有疾病进展(定义为CDR-SB评分没有下降),而安慰剂组这一比例为29%。
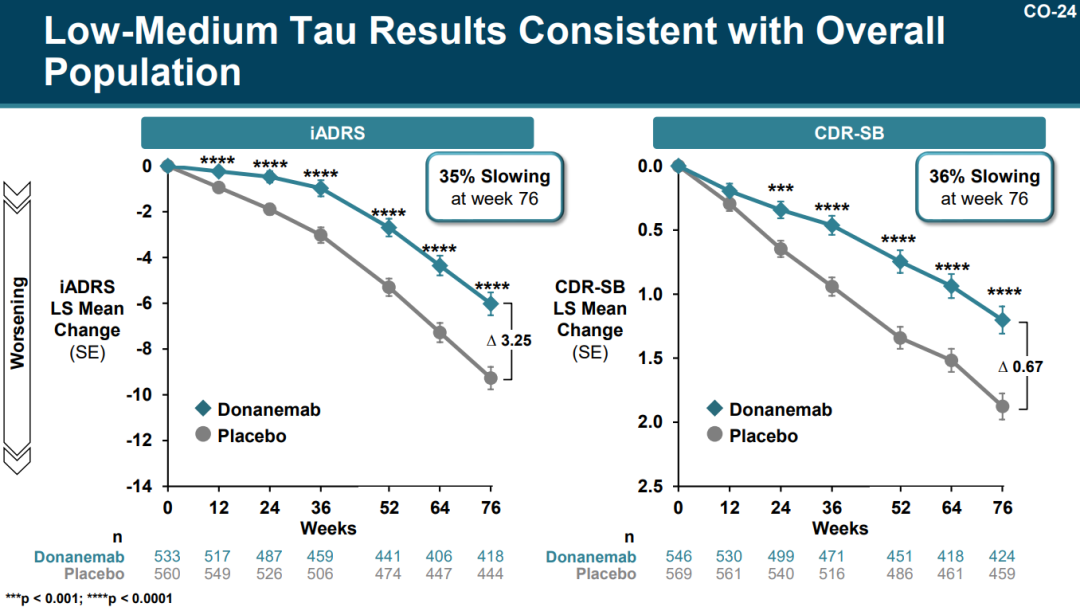
来源:PCNS会议礼来PPT
此外,Donanemab将患者的疾病进展至下一阶段的风险降低了37%(HR=0.626; p<0.0001)。
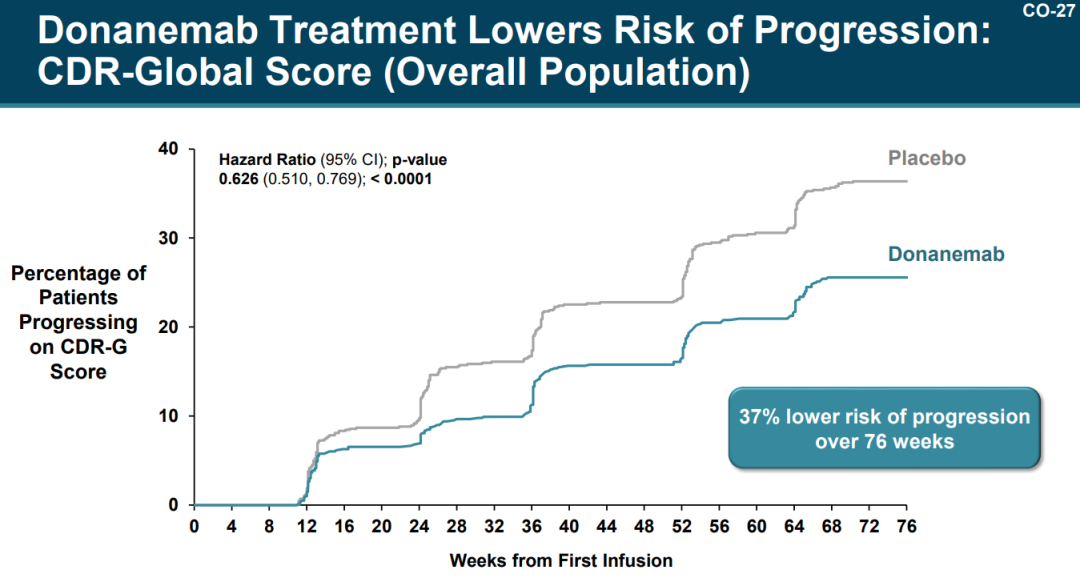
来源:PCNS会议礼来PPT
安全性方面,Ddonanemab组有24%患者出现经MRI确认的淀粉样蛋白相关影像学异常-水肿(ARIA-E),6%患者出现有症状的ARIA-E;Donanemab组有31.4%患者出现脑微出血和浅表铁质沉积(ARIA-H),安慰剂组为13.6%。大多数ARIA的严重程度为轻度至中度,严重ARIA发生率为1.6%,包括两例患者因ARIA和严重ARIA而死的患者;有8.7%患者出现输液相关反应,大多为轻度至中度。
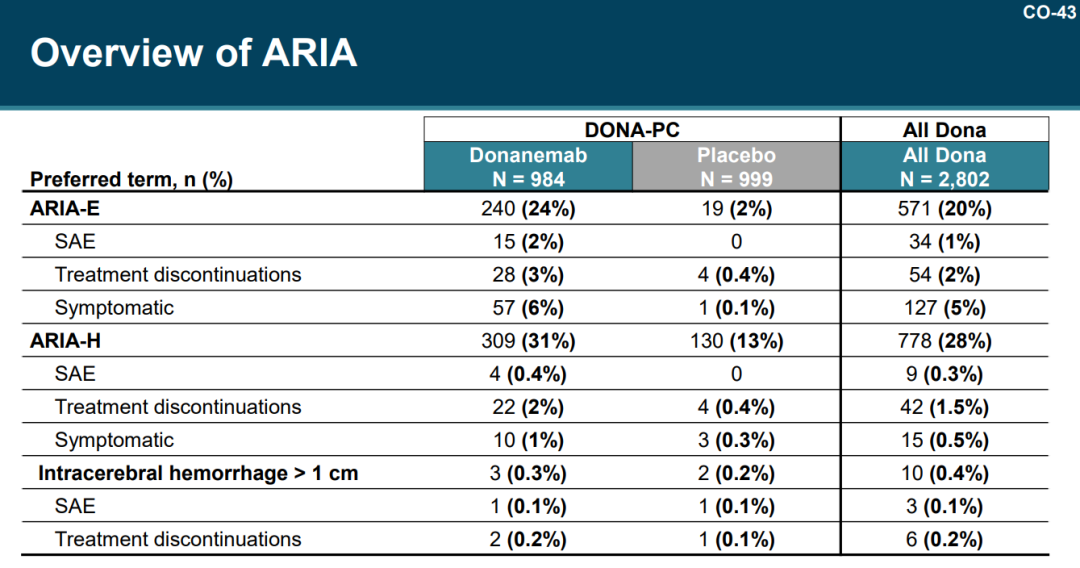
来源:PCNS会议礼来PPT
▌关键问题及投票结果

来源:PCNS会议
问题背景:礼来在TRAILBLAZER-ALZ 2研究中纳入了低/中/高tau蛋白水平的早期症状性AD患者,排除了无法检测到或极低tau蛋白水平的患者;TRAILBLAZER-ALZ 2研究的安全性扩展研究额外纳入了无法检测到或极低tau蛋白水平的患者。结果表明,Donanemab在低/中tau蛋白水平人群中的疗效优于高tau蛋白水平人群;无法检测到或极低tau蛋白水平的患者在接受治疗后也有所获益。
投票结果:11:0投票赞成现有数据可以证明Donanemab治疗早期症状性AD的有效性。
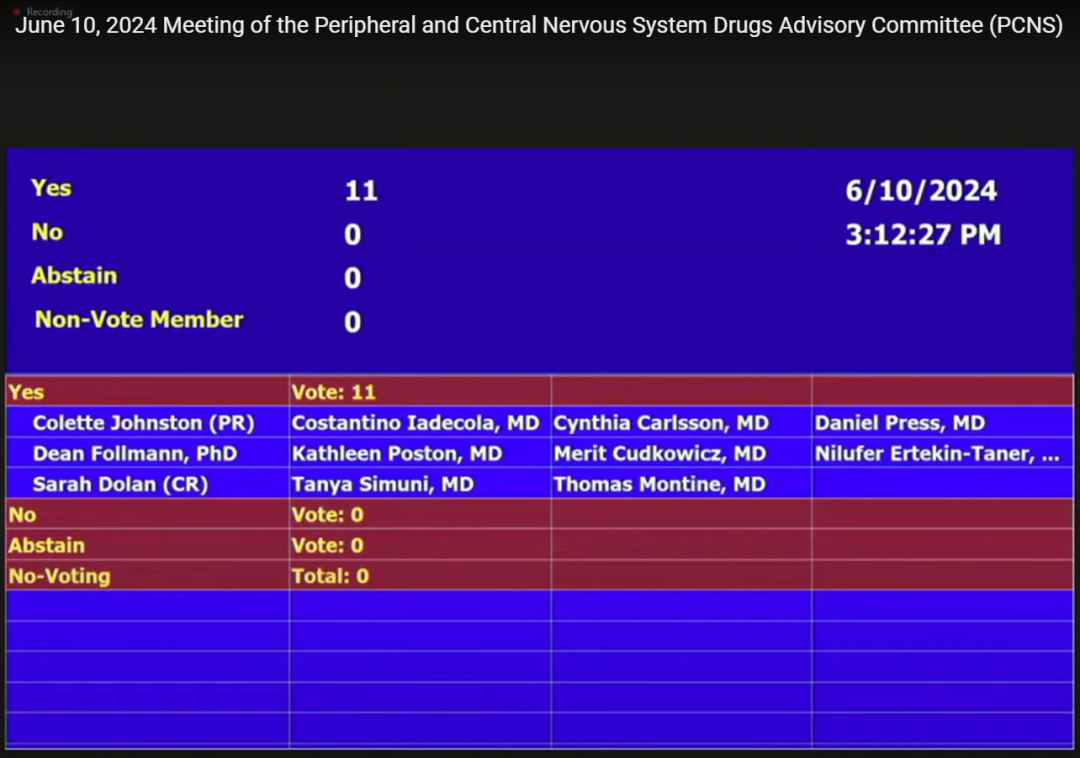
来源:PCNS会议
关键问题2:早期症状性AD患者接受Donanemab治疗后的整体获益-风险情况?

来源:PCNS会议
问题背景:在TRAILBLAZER-ALZ 2研究中,Donanemab组患者的iADRS评分下降速度显著延缓,但下降幅度较小;治疗第24周、52周和76周时分别有17%、42%和60%的患者能够停药;仑卡奈单抗目前未考虑过停药方案;3例患者在研究中因ARIA死亡。
投票结果:11:0投票赞成早期症状性AD患者接受Donanemab治疗后的整体获益大于风险。
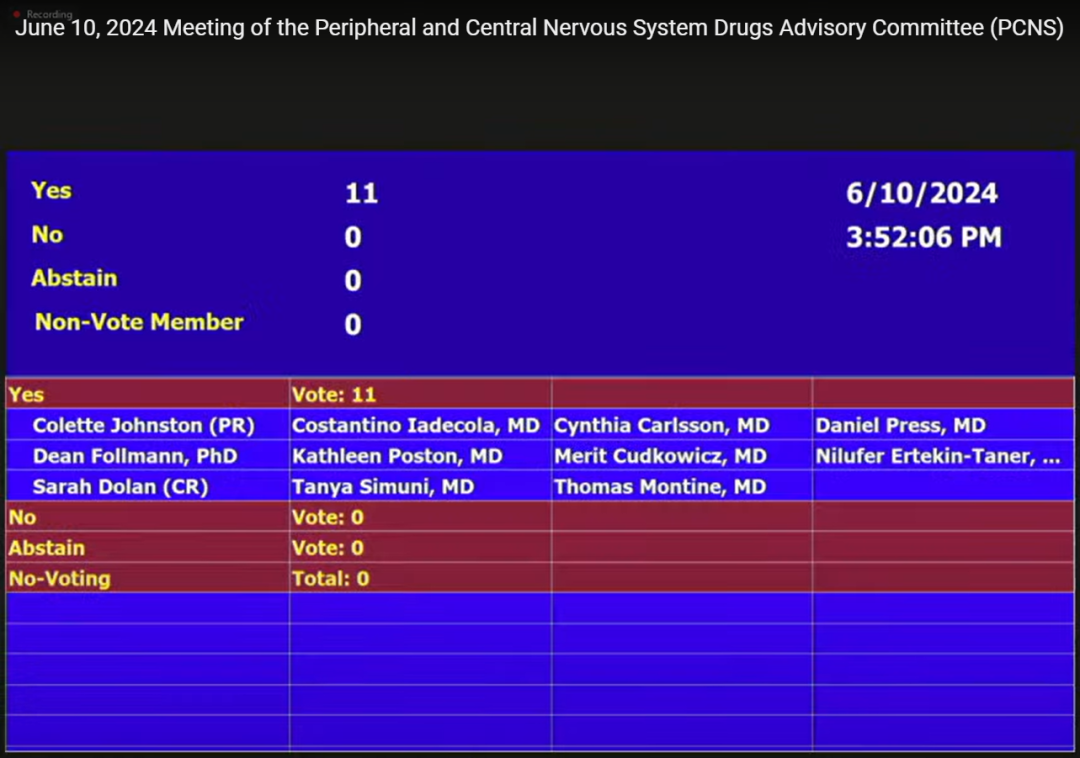
来源:PCNS会议
经此一战,Donanemab有望守得云开见月明。期待FDA的监管决定!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


