CD39—癌症免疫疗法的新生力量!艾伯维、科望医药等均在开发
来源:医药观澜 2020-08-24 12:59
免疫疗法是当下肿瘤主要治疗手段之一,但其效果会受多种因素影响,肿瘤微环境(TME)就是重要的影响因子之一。研究发现,肿瘤微环境中的免疫细胞组成常常会影响其对某种特定疗法的响应,从而决定癌症免疫疗法的成败。而在肿瘤微环境的先天性和适应性免疫中,ATP-腺苷通路起着关键作用。CD39是ATP-腺苷通路中的一员,因在肿瘤微环境免疫抑制反应中扮演的重要角
免疫疗法是当下肿瘤主要治疗手段之一,但其效果会受多种因素影响,肿瘤微环境(TME)就是重要的影响因子之一。研究发现,肿瘤微环境中的免疫细胞组成常常会影响其对某种特定疗法的响应,从而决定癌症免疫疗法的成败。而在肿瘤微环境的先天性和适应性免疫中,ATP-腺苷通路起着关键作用。
CD39是ATP-腺苷通路中的一员,因在肿瘤微环境免疫抑制反应中扮演的重要角色,近年来逐渐受到关注。根据公开资料,全球范围内,目前有至少3款CD39靶向药物进入临床试验,还有一些药物正处于临床前研究阶段,来自Tizona Therapeutics/艾伯维(AbbVie)、Innate Pharma/阿斯利康(AstraZeneca)、科望医药等公司。
本文中,我们将结合近期发表在Nature Reviews Immunology上的一篇文章,以及公开资料,带大家了解下CD39这个癌症免疫疗法领域的新生靶点及其研发概况。
CD39与肿瘤
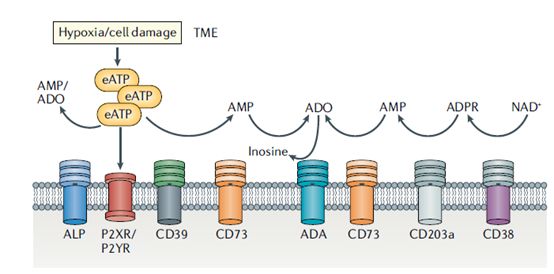
ATP-腺苷(ATP–adenosine)途径是肿瘤微环境(TME)中先天性和适应性免疫的关键调节剂。应激或死亡细胞释放的ATP可提供炎症信号,这对有效的先天和适应性免疫反应至关重要。相反,细胞外ATP(eATP)水解成胞外腺苷则限制了免疫反应。eATP水解成胞外腺苷的过程主要通过CD39和CD73两种外切酶的级联反应发生,其中CD39是eATP水解中的关键限速酶。
CD39是一种胞外核苷酸水解酶,它可结合eATP并将其转化为细胞外腺苷,抑制免疫反应。研究表明,CD39在各种人类肿瘤中均呈现高表达现象,包括淋巴瘤、肉瘤、慢性淋巴细胞白血病、肺癌、胰腺癌、卵巢癌、肾癌、甲状腺癌和睾丸癌等等。虽然在某些情况下,与正常细胞相比,肿瘤细胞会过表达CD39,但在肿瘤微环境中, CD39表达水平升高的细胞类型是血管内皮细胞、成纤维细胞和一些免疫细胞。
研究发现,在巨噬细胞、骨髓来源的抑制细胞、效应T细胞、自然杀伤(NK)细胞、调节性T(Treg)细胞等多种免疫细胞中,CD39都发挥着重要的作用(见表1)。例如,在巨噬细胞中,CD39可作为一个“分子变阻器”,控制炎症和调节巨噬细胞分化之间的平衡。骨髓来源的抑制性细胞(MDSC)的积累被认为是癌细胞的重要免疫逃逸机制,在MDSC中,CD39的表达与肿瘤分期呈正相关。而在自然杀伤细胞和Treg细胞等细胞中,CD39可以增强免疫抑制活性。
鉴于CD39在肿瘤微环境中的扮演的重要角色,它已成为研究人员开发肿瘤免疫疗法的一个新兴靶点。
表1:CD39的作用和抑制CD39对肿瘤微环境中不同免疫细胞的影响
CD39靶向疗法的抗癌机制
在肿瘤微环境中,靶向CD39阻断腺苷介导的免疫抑制可以抑制肿瘤生长,其机理主要包括两部分:
1)一方面,阻断CD39的ATP酶活性不但可减少腺苷的生成,也维持了肿瘤微环境中的ATP水平,ATP可活化树突状细胞(DC细胞),并进一步促进DC细胞对T细胞的激活。
2)另一方面,CD39在调节性T细胞和耗竭性T细胞上高表达,阻断CD39的活性可以降低调节性T细胞的免疫抑制功能并且重新活化耗竭性T细胞。
不过研究发现,在肿瘤微环境内,CD39靶向疗法实则可通过多种机制来增强抗肿瘤免疫力,包括减轻腺苷介导的T细胞免疫抑制、激活巨噬细胞中的炎症小体、影响NK细胞功能、抑制Treg细胞免疫抑制作用、增加抗原呈递细胞(APC)成熟度等等(见下图)。总的来说,这些机制主要通过增加eATP,或减少腺苷生成来发挥作用。
全球至少三款CD39靶向药迈入临床开发
根据公开信息,目前全球有至少3款在研靶向CD39的药物迈入临床试验,还有一些尚在临床前研究阶段,Tizona Therapeutics/艾伯维、Innate Pharma/阿斯利康、Surface Oncology、科望生物等公司均有在研项目。以下仅节选部分CD39在研靶向药做介绍。
1、Tizona Therapeutics/艾伯维:TTX-030
TTX-030是Tizona公司开发的一款“first-in-class”CD39单克隆抗体。TTX-030可通过抑制CD39的功能,防止免疫抑制性细胞外腺苷的形成,并维持高水平的细胞外ATP,从而刺激先天性和适应性免疫所必需的树突状细胞和髓样来源的细胞。2019年1月,艾伯维和Tizona公司宣布达成全球性战略合作协议,共同开发和推广靶向CD39的癌症疗法,其中包括TTX-030。
Cllinicaltrials.gov网站信息显示,TTX-030正在进行两项1期临床试验:一项研究旨在评估TTX-030联合budigalimab和/或化疗对晚期实体肿瘤患者的安全性和活性;另一项旨在淋巴瘤或恶性实体瘤患者中,评估TTX-030单药或与PD-1抑制剂pembrolizumab或化疗联合治疗的安全性、耐受性、药代动力学和抗肿瘤活性。
值得一提的是,2020年7月21日,吉利德科学( Gilead Sciences)已宣布将对Tizona公司进行3亿美元的股权投资,获得后者49.9%的股权。同时,吉利德还拥有收购后者剩余50.1%股权的独家选择权。
2、Innate Pharma/阿斯利康:IPH5201
IPH5201是Innate Pharma公司开发的一款靶向CD39的人源化单克隆抗体,可选择性结合并抑制膜结合CD39和可溶性人源CD39的活性。2018年10月,Innate Pharma与阿斯利康签署一项开发合作和选择协议,以进一步共同开发和商业化IPH5201。
根据Innate Pharma官网信息,体外研究显示,IPH5201可保留细胞外ATP,促进DC和巨噬细胞的活化,并通过阻止ATP降解来阻止腺苷积累,从而限制腺苷对T细胞的免疫抑制作用。同时,体内和体外研究数据表明,CD39抗体与PD-1/PD-L1检查点抑制剂联用可提高抗肿瘤功效。
目前,IPH5201正在开展一项放标签、剂量递增的1期临床试验,该研究旨在晚期实体瘤中评估IPH5201作为单药,或与durvalumab(PD-L1单抗)±oleclumab(CD73单抗)联合的安全性、耐受性、抗肿瘤活性和药代动力学。
3、Surface Oncology:SRF617
SRF617是Surface Oncology公司开发的一款CD39抑制剂。2020年5月,Surface Oncology与默沙东(MSD)宣布达成一项临床试验合作,评估SRF617与默沙东的重磅PD-1抑制剂Keytruda联合,治疗实体瘤患者的安全性和有效性。这种联合疗法将作为SRF617首次1/1b期临床研究的一个组成部分,其重点是治疗胃癌和对检查点抑制剂产生耐药性的癌症患者。
CD39是三磷酸腺苷(ATP)分解和腺苷生成过程中至关重要的酶。大量的研究证实了CD39在癌症逃避免疫反应中的作用。例如,在胃癌中,肿瘤内的免疫细胞通常表达高水平的CD39,即使存在抗PD-1抗体,这也可能损害整体的抗癌免疫反应。SRF617和Keytruda组成的联合疗法具有克服这种阻碍免疫系统激活的障碍,并增强抗肿瘤免疫力的潜力。
4、科望医药:ES002
ES002是科望医药(Elpiscience) 开发的一种具有高亲和力、能高效阻断CD39蛋白ATP酶活性的抗CD39单克隆抗体。ES002可通过阻断CD39蛋白ATP酶活性、解除调节性T细胞的免疫抑制、招募APC和NK细胞发挥功能,在动物体内药效实验中展现了很强的抑制肿瘤生长的功能。目前,科望医药的ES002抗CD39抗体已进入工艺开发及临床前研究阶段。
5、Secarna:靶向CD39的反义寡核苷酸
除了上述CD39抑制剂,也有一些公司在开发靶向CD39的反义寡核苷酸(ASO),Secarna公司就是其中之一。Secarna是一家新型生物制药公司,旨在利用其专用的药物研发平台LNAplus?,开发下一代反义寡核苷酸药物。反义寡核苷酸是一种短链核苷酸,它的碱基序列与其目标RNA的序列互补。当反义寡核苷酸药物进入细胞后,它可以结合并降解目标RNA,以达到抑制致病基因表达的目的。
Secarna公司官网资料显示,其在研产品管线中包括多种下一代反义寡核苷酸药物,其中靶向CD39的反义寡核苷酸药物目前处于临床前研究阶段。根据2019年发表在Journal for Immuno Therapy of Cancer期刊上的一篇文章,CD39特异性反义寡核苷酸通过有效和持续抑制T细胞上CD39的表达来恢复ATP供应,从而改善T细胞增殖,增强免疫作用。
联合疗法或是主要研发方向
从已有研发情况来看,研究人员更多在探索CD39靶向药物与其它药物的联合治疗情况,这些药物包括其它腺苷通路抑制剂(CD73、A2A受体等)、PD-1/ PD-L1抗体、化疗/放疗等等,其中与PD-1/ PD-L1抗体和放化疗的联合研究较多。此外,文章指出,还有一些疗法也可作为CD39靶向药的联合研究对象,例如过继细胞转移疗法、CTLA-4抑制剂等等,这些联合疗法策略也有望为患者带来潜在的益处。
值得注意的是,与A2A、CD73等腺苷通路的靶向药物研究相比,靶向CD39的药物研究尚处于早期阶段。目前,尚未有CD39靶向药物的临床研究数据发表。因此,在解释早期临床结果时要谨慎。对于CD39免疫疗法在肿瘤治疗中究竟有多大潜力,还需要更多的临床试验数据来验证。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


