2023年8月Science期刊精华
来源:生物谷原创 2023-08-30 17:35
2023年8月份即将结束,8月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2023年8月份即将结束,8月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
doi:10.1126/science.adh5021
寿命较短的蛋白控制细胞中的基因表达,执行着许多重要任务,从帮助大脑形成连接到帮助身体进行免疫防御。这些蛋白在细胞核中产生,一旦完成任务就会迅速被破坏。尽管这些蛋白非常重要,但几十年来,科学家们一直不知道它们在不再需要时遭受降解并从细胞中清除的过程。
在一项新的研究中,来自美国哈佛医学院的研究人员发现了一种名为 midnolin 的蛋白,它在降解许多寿命较短的核蛋白的过程中发挥着关键作用。他们的研究表明,midnolin 通过直接抓住这些蛋白并将它们拉入细胞废物处理系统---蛋白酶体(proteasome)---中,在那里将它们破坏。相关研究结果发表在2025年8月25日的Science期刊上,论文标题为“The midnolin-proteasome pathway catches proteins for ubiquitination-independent degradation”。

midnolin-蛋白酶体途径对许多核蛋白的降解并不依赖于泛素化。图片来自Science, 2023, doi:10.1126/science.adh5021。
这些作者从两种熟悉的转录因子入手:Fos和EGR1。他们着重关注midnolin这种有助于降解这两种转录因子的蛋白。后续实验发现,除了 Fos 和 EGR1,midnolin 还可能参与降解细胞核中的数百种其他转录因子。
借助一种名为 AlphaFold 的机器学习工具(可预测蛋白质结构),再加上一系列实验室实验的结果,这些作者得以充实这一机制的细节。他们发现,midnolin有一个“捕捉结构域(Catch domain)”---该蛋白的一个能捕捉其他蛋白并将它们直接送入蛋白酶体以便随后遭受降解的区域。这个“捕捉结构域”由两个独立的区域组成,这两个区域通过氨基酸连接在一起,可以抓住蛋白中一个相对非结构化的区域,从而使得 midnolin 能够捕捉多种不同类型的蛋白。
值得注意的是,像Fos这样的蛋白负责打开基因,促使大脑中的神经元根据刺激进行接线和重新接线。其他蛋白,如IRF4,通过确保细胞能够制造功能性B细胞和T细胞来激活支持免疫系统的基因。
2.Science:科学家开发出了一种新型的KRAS解决策略 或有望克服“不可药用”的障碍
doi:10.1126/science.adg9652
小分子抑制剂的发现需要再蛋白质表面有合适的结合袋,缺乏这一特征的蛋白质被认为是不可药用的,这就需要创新性的治疗性策略;KRAS是癌症中最为频繁的被激活的癌基因,而KRAS突变体的激活状态则是一个令人难以捉摸的靶标。近日,一篇发表在国际杂志Science上题为“Chemical remodeling of a cellular chaperone to target the active state of mutant KRAS”的研究报告中,来自纽约纪念斯隆凯特琳癌症研究中心等机构的科学家们通过研究开发了一种新方法,其或能绕过一种常见的致癌突变不可药用特质,这种致癌突变会驱动癌症发生以及对当前疗法的耐受性。
在这篇文章中,研究人员引入饿了一种能靶向作用活性突变KRAS的新方法,从而就有望解决“不可药用”的挑战(undruggable challenge);KRAS是一种臭名昭著的经常与多种癌症发生相关的细胞信号基因,其在驱动失控的细胞生长和增殖方面扮演着重要角色,KRAS突变存在于大约25%的肿瘤中,且是32%的肺癌、40%的结直肠癌和85%的胰腺癌病例背后的驱动突变,KRAS突变是人类机体中最常发生的致癌突变。
这项研究中,研究人员制造出了一种名为RMC-6291的小分子,其具有精确靶向的新形态结合界面,研究人员战略性地改造了RMC-6291分子使其能与天然细胞伴侣CYPA和KRAS蛋白上的点突变形成三重复合体,当RMC-6291处于交叉位置时,这种相互作用就会被干扰,从而关闭由KRAS所驱动的型号通路。除了适用于KRAS的单点突变外,该研究还强调了这种方法策略必须扩展到其他具有挑战性的目标的潜力,这或许就为解决此前被认为超出药物开发范围的更广泛的致癌基因提供了一定的可能性。
3. 1篇Science和1篇Nature子刊揭示哺乳动物的寿命与DNA甲基化密切相关
doi:10.1126/science.abq5693; doi:10.1038/s43587-023-00462-6
在两项新的研究中,来自包括美国加州大学洛杉矶分校在内的哺乳动物甲基化联盟(Mammalian Methylation Consortium)的研究人员详细介绍了人类和其他哺乳动物在历史上共有的DNA变化,并且这些变化与寿命和其他许多性状有关。这两项研究着重关注一种称为胞嘧啶甲基化(cytosine methylation)的DNA甲基化,其中第一项研究发表在2023年8月11日的Science期刊上,论文标题为“DNA methylation networks underlying mammalian traits”,第二项研究于2023年8月10日在线发表在Nature Aging期刊上,论文标题为“Universal DNA methylation age across mammalian tissues”。
作为这两篇论文的通讯作者,加州大学洛杉矶分校的Steve Horvath博士说,“我们发现哺乳动物的寿命与 DNA 分子的化学修饰密切相关,这种化学修饰被称为表观遗传学,更准确地说,是甲基化。从本质上讲,寿命较长的哺乳动物的DNA甲基化景观更为明显,而寿命较短的哺乳动物的DNA甲基化模式则更为柔和和平坦。”
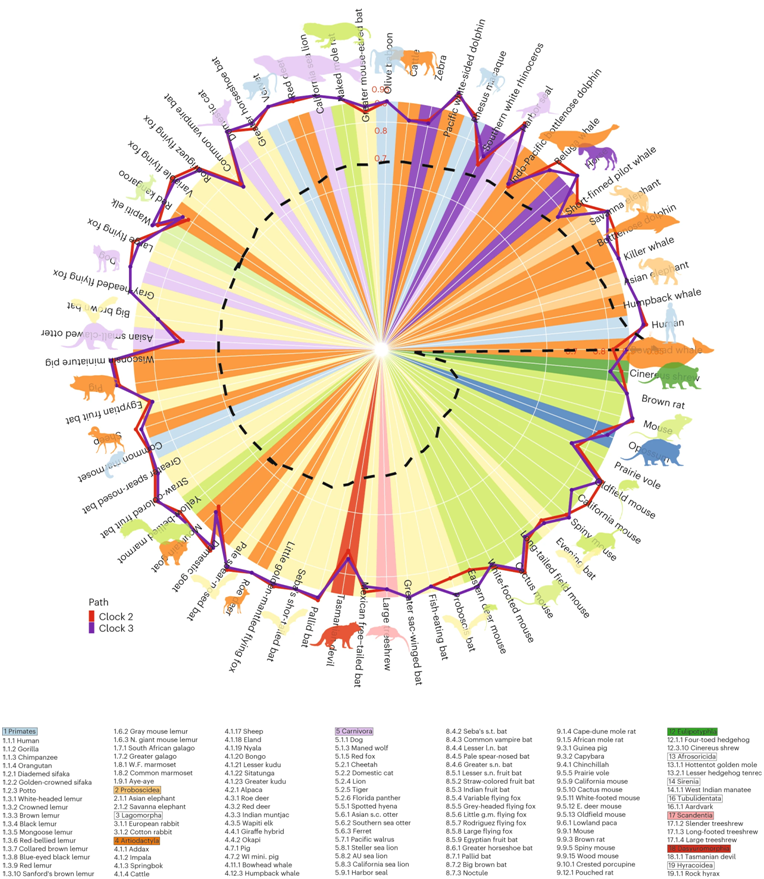
通用时钟的精度与哺乳动物物的种寿命无关。图片来自Nature Aging, 2023, doi:10.1038/s43587-023-00462-6。
加州大学洛杉矶分校生物化学、计算机科学和计算医学教授Jason Ernst说,“我们设计的测量哺乳动物DNA甲基化水平的技术,加上来自众多研究人员的组织样本贡献,产生了一个非常独特的数据集,在用先进的计算和统计工具对该数据集进行分析后,揭示了对哺乳动物DNA甲基化、寿命、衰老和其他生物过程之间关系的更深入理解。”
为了研究DNA甲基化的影响,这些作者收集并分析了来自348个哺乳动物物种的15000多个动物组织样本的甲基化数据。他们发现,甲基化谱的变化与进化过程中遗传的变化密切相关,这表明基因组和表观基因组的进化相互交织,影响着不同哺乳动物物种的生物特征和性状。
4.Science:我国科学家领衔揭示源自中草药的化合物Dau-d4可改善现有糖尿病药物的疗效
doi:10.1126/science.add5787
肠道菌群可以通过产生与宿主酶的功能相似的酶来调节宿主的生理和病理生理学。然而,通过基于测序的研究很难确定这些微生物-宿主同工酶(microbial-host isozyme),因为在不同物种中具有相似功能的酶可能缺乏序列保守性。基于活性的功能蛋白筛选框架对于发现和鉴定这类微生物-宿主同工酶更为可靠,有助于深入了解肠道菌群-宿主之间的交谈。
为了确定潜在的微生物-宿主同工酶,来自中国北京大学、首都医科大学、四川大学和美国国家癌症研究所的研究人员在一项新的研究中建立了一种酶活性筛选平台,包括对 110 种在多种人类疾病中起作用的酶进行活性测定。这些酶的活性是在源自粪便的体外细菌群落中测定的。二肽基肽酶 4(dipeptidyl peptidase 4, DPP4)是他们筛选出的一种重要的微生物-宿主同工酶,但人们对它对宿主的病理生理影响知之甚少。他们试图确定源自肠道菌群的 DPP4 是否会像宿主 DPP4(host DPP4, hDPP4)一样降低活性 GLP-1,从而影响血糖稳态。相关研究结果发表在2023年8月4日的Science期刊上,论文标题为“Microbial-host-isozyme analyses reveal microbial DPP4 as a potential antidiabetic target”。
通过这种酶活性筛选平台,这些作者在人类肠道菌群中发现了 71 种具有阳性活性的酶,其中大部分的酶在无菌小鼠和无特定病原体小鼠粪便的蛋白提取物中得到了验证。在这些已确定的酶中,DPP4 活性在 10 个人类样本中具有最高的统计效应大小(Z 因子)。通过人体肠道细菌分离和 DPP4 活性筛选,他们发现微生物 DPP4 主要由拟杆菌(Bacteroides spp.)产生,肠道微生物 DPP4(microbial DPP4, mDPP4)可在体外降解活性 GLP-1(7-37)。然而,mDPP4不能影响饲料喂养小鼠体内的活性GLP-1水平,但能降低高脂饮食(HFD)喂养小鼠或用右旋糖酐硫酸钠/吲哚美辛处理的小鼠体内的活性GLP-1活性并损害葡萄糖稳态,这表明肠道屏障受损是mDPP4影响宿主GLP-1活性所需的。
这些作者发现,临床 DPP4 抑制剂西他列汀(sitagliptin)未能有效抑制 mDPP4。通过在 1.97 埃的分辨率下解析 mDPP4 与西他列汀的共晶体,他们发现这种药物与 mDPP4 之间的结合性质与它与 hDPP4 之间的结合性质不同,这可能是抑制作用不同的原因。一项针对 2 型糖尿病 (T2D) 患者(n=57)的西他列汀临床试验(NCT04495881)和一项将这项新研究中高应答者和低应答者的粪便移植到高脂饮食喂养的小鼠体内的相关粪便微生物群研究表明,mDPP4 可限制西他列汀对 T2D 患者和葡萄糖耐受不良小鼠的疗效。
为了确定 mDPP4 的选择性抑制剂,这些作者筛选了大约107000 种化合物,并通过结构修饰确定了相比于 hDPP4 相比,Dau-d4作为蝙蝠葛苏林碱(daurisoline)的一种衍生物,能选择性地抑制 mDPP4 的活性。Dau-d4 能提高糖尿病小鼠体内 GLP-1 的活性水平并改善它们的葡萄糖代谢,而且Dau-d4 与西他列汀组合使用能进一步改善血糖稳态。
5.Science:科学家识别出169个基因或与人类皮肤、头发和眼睛中黑色素的产生直接相关
doi:10.1126/science.ade6289
肤色是最多样化的人类特征之一,其是由黑色素的数量、类型和分布来决定的。近日,一篇发表在国际杂志Science上题为“A genome-wide genetic screen uncovers determinants of human pigmentation”的研究报告中,来自斯坦福大学医学院等机构的科学家们通过研究将169个基因与皮肤、头发和眼睛中的黑色素的产生联系了起来,文章中,研究人员对细胞样本进行了流式细胞分析和全基因组CRISPR筛选。
此前研究结果表明,黑色素在体内的产生和分布与肤色、头发颜色和眼睛色素沉着有关,这些特征要比外表更加重要,比如拥有更多黑色素的皮肤能够更好地保护机体抵御紫外线的照射。这项研究中,研究人员指出,尽管他们识别出了很多基因与黑色素的产生有关,但还有更多的基因或许并未被识别出来。

科学家识别出169个基因或与人类皮肤、头发和眼睛中黑色素的产生直接相关。图片来源:Science (2023). DOI:10.1126/science.ade6289
于是研究人员开始努力区分高黑色素细胞和低黑色素细胞(即能制造黑色素的细胞),他们利用黑色素的反射光特性,将荧光对准实验室培养皿中的细胞对其进行分类,一旦确定了细胞的分类,研究人员就利用CRISPR-Cas9技术对其进行编辑,基因会被系统性地突变来关闭其表达,随后研究人员再对其进行检测来观察细胞持续产生黑色素的情况。
最后,研究人员发现了169个基因在黑色素产生过程中扮演重要作用,其中135个基因此前并未被发现,接下来他们在所捐赠的婴儿包皮(foreskins)组织中来测试研究结果,结果发现,他们所分离出的近70%的基因在深色皮肤的婴儿中要比浅色皮肤的婴儿中更加活跃。研究人员注意到,并不是他们所分离的所有基因都直接与黑色素的产生有关,有些基因还参与到了多样化的生物性功能中,研究者进一步指出,他们能够将这些基因群分为两个主要类型,即那些能帮助调节基因的基因群和能帮助运输核内体(endosomes)的基因群,同时研究人员还发现,他们所识别出的基因中至少有一种基因在黑色素体的成熟过程中起作用,而另一个基因会参与调节pH的水平。
6.Science:利用经过基因改造的巴氏不动杆菌在体内检测肿瘤DNA
doi:10.1126/science.adf3974
一种名为巴氏不动杆菌(Acinetobacter baylyi)的细菌通常是非致病性的,而且天生就能通过水平基因转移摄取周围环境中的DNA。在一项新的研究中,来自美国加州大学圣地亚哥分校、澳大利亚南澳大利亚健康与医学研究所和阿德莱德大学的研究人员利用这一特性,对这种细菌进行了基因改造,只有当它们摄取了含有特定癌基因(比如KRAS)中癌症相关突变的DNA,而不是野生型对应DNA时,它们才会对特定抗生素药物产生抗药性。这种经过基因改造的细菌在体外培养的携带相关突变的细胞中检测到它们的靶标,而且在直肠灌肠给送后,在携带相关突变肿瘤的结直肠癌小鼠模型中,观察到了从肿瘤到这种细菌的水平基因转移,这使得这种细菌检测到了它们的靶标,这将为开发能够识别各种感染、癌症和其他疾病的新型生物传感器铺平道路。相关研究结果发表在2023年8月11日的Science期刊上,论文标题为“Engineered bacteria detect tumor DNA”。
细菌以前经过基因改造后用于执行各种诊断和治疗功能,但缺乏识别细胞外特定 DNA 序列和突变的能力。在这项新的研究中,他们开发出的“靶向CRISPR识别水平基因转移的细胞检测(Cellular Assay for Targeted CRISPR-discriminated Horizontal gene transfer, CATCH)”就是为了实现这一目的而设计的。
这些作者对贝氏不动杆菌进行基因改造,将它们作为识别 KRAS的传感器,其中KRAS是一个在很多癌症中发生突变的基因。他们用一种CRISPR 系统对这种细菌进行了编程,以便让它们能够区分 KRAS 的突变拷贝和正常(非突变)拷贝。这意味着只有摄取了突变形式的KRAS(例如在癌前息肉和癌症中发现的KRAS突变拷贝)的贝氏不动杆菌才能存活下来,对疾病发出信号或做出反应。
这项新的研究基于以前与水平基因转移(horizontal gene transfer)有关的想法,其中水平基因转移是生物之间相互移动遗传物质的一种方法,其方式有别于传统的亲代与后代之间的遗传。虽然细菌与细菌之间的水平基因转移广为人知,但是这些作者实现了将这一概念从哺乳动物肿瘤和人类细胞应用到细菌中的目标。
7.Science:天然存在的戴尔福特菌及其分泌的哈尔满碱有潜力控制疟疾传播
doi:10.1126/science.adf8141
在一项新的研究中,美国约翰斯-霍普金斯大学布隆伯格公共卫生学院分子微生物学与免疫学名誉教授Marcelo Jacobs-Lorena博士和他的同事们与葛兰素史克全球健康药物研发部门的研究人员合作,证实了一种天然存在的细菌及其分泌的一种化学物能抑制蚊子体内疟原虫的发育,这意味着蚊子无法将疟原虫传播给人类。这种方法具有明显的优势:它技术含量低,易于复制,而且不使用基因改造技术。这种方法还能与现有的有效控制策略完美配合。相关研究结果发表在2023年8月4日的Science期刊上,论文标题为“Delftia tsuruhatensis TC1 symbiont suppresses malaria transmission by anopheline mosquitoes”。
这项新的研究始于葛兰素史克公司在西班牙的实验室,那里的科学家们正在研究疟疾药物。为了测试这些药物,他们用一种称为恶性疟原虫(Plasmodium falciparum)的疟原虫定期感染蚊子。随着时间的推移,他们无法再感染这些蚊子。他们寻找可能的原因,发现在所有筛查的蚊子样本中都存在一种戴尔福特菌(Delftia tsuruhatensis)菌株(他们将该菌株命名为 Tres Cantos 1,简称TC1)。
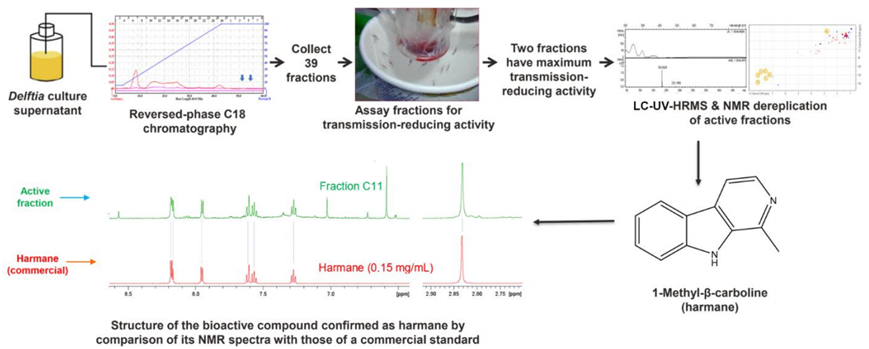
通过戴尔福特菌体外培养的上清液的生物测定引导的分馏鉴定抑菌化合物。图片来自Science, 2023, doi:10.1126/science.adf8141。
首先,这些作者把 TC1 细菌喂给他们的实验室中的蚊子,证实这种细菌抑制了蚊子体内的疟原虫发育。接着,论文第一作者、Jacobs-Lorena实验室高级助理研究员Wei Huang发现,如果培养这种细菌,然后用上清液(培养液中不包括细胞的液体)喂养蚊子,蚊子体内的疟原虫发育会受到抑制。这表明这种上清液中含有抑制剂,细菌通过分泌抑制剂来攻击疟原虫。
此时,葛兰素史克公司委托西班牙Fundación MEDINA对这种上清液进行分馏[将混合物分离成各个组分]以确定这种抑制剂,然后将每个馏分寄回给Jacobs-Lorena团队,该团队将每个馏分与受到疟原虫感染的血液混合喂食蚊子进行测试。通过这种方法,该团队确定了哪个馏分含有抑制剂。
最终,Fundación MEDINA的科学家们确定这种具有抑制作用的化合物就是哈尔满碱(harmane)。原来,哈尔满碱可以很容易地从化工公司购买到。Jacobs-Lorena团队订购了这种化合物,并确认它对疟原虫有抑制作用。
随后,Wei有了一种不同的测试想法:他把哈尔满碱干燥在玻璃板上,让蚊子在玻璃板上静置一小时,然后给蚊子喂受到疟原虫感染的血液。他发现,静置在哈尔满碱上的蚊子体内的疟原虫发育受到严重影响,这意味着哈尔满碱可以穿透蚊子的角质层(蚊子腿部的外层),抑制疟原虫发育。
8.Science:科学家揭示肿瘤中基因表达的一种特殊协调机制
doi:10.1126/science.ade2292
肿瘤微环境(TMEs)影响着癌症的进展,而且其非常复杂且在不同患者之间存在一定的差异。近日,一篇发表在国际杂志Science上题为“CXCL9:SPP1 macrophage polarity identifies a network of cellular programs that control human cancers”的研究报告中,来自路德维希癌症研究中心等机构的科学家们通过研究识别出了一对基因,其在肿瘤内的一种免疫细胞中的表达或能帮助预测癌症患者的治疗结局,且与肿瘤微环境中多细胞类型参与的基因表达程序的庞大网络有关,这些基因表达程序网络能控制人类癌症的进展。
研究者认为,机体中肿瘤相关巨噬细胞中CXCL9基因高表达的患者要比机体中免疫细胞中SPP1基因高表达的患者的临床结局要好,表达前者基因的巨噬细胞总是能准备好攻击癌细胞,而能表达SPP1的巨噬细胞则处于支持肿瘤生长的状态;然而,有意思的是,当肿瘤微环境中CXCL9与SPP1的比率较高时,其它肿瘤微环境细胞中的基因表达程序则会显示出类似的抗肿瘤倾向,而从另一方面来讲,较低的CS比率(CXCL9与SPP1)总是伴随着整个肿瘤微环境的促肿瘤基因表达特征。
肿瘤微环境中的非癌变细胞在肿瘤的生长和生存过程中也发挥着重要作用,这些细胞包括能大量产生组织分子填料的成纤维细胞、构建血管的内皮细胞、排列在体腔的上皮细胞以及多种能帮助或阻碍肿瘤生长的免疫细胞种类;靶向作用这些细胞治疗癌症的可能性是非常诱人的,因为相比恶性细胞而言,这些细胞并不太会快速突变以及不太会进化对疗法耐受。研究者Pittet及其同时非常感兴趣研究不同肿瘤之间的肿瘤微环境到底有多少差异,为了找到答案,他们对来自51名头颈癌的52份原发和转移性肿瘤样本进行无偏见的分析,检查了单一细胞中所捕获的整体基因表达情况,并在整个肿瘤中进行了统计分析来研究其与患者结局是否相对应。
研究人员识别出了CXCL9和SPP1(其在单个巨噬细胞中的表达是互相排斥的)基因,其与患者的预后密切相关,而且这也在其它实体瘤中被证明是正确的;研究人员发现,这两个基因的表达与巨噬细胞的抗肿瘤和促肿瘤“极性”的关系要比目前所使用的标志物更加明确。值得注意的是,CXCL9和SPP1表达的比率(称之为CShi或CSlow)与头颈癌肿瘤中其它类型的肿瘤微环境的状态是大致一致的,并与一些促肿瘤效应和抗肿瘤效应相关的现象一致,比如,Cshi肿瘤更容易被B细胞、树突状细胞和T淋巴细胞浸润,这些细胞都会驱动抗肿瘤免疫;此外,这些肿瘤中的其它细胞类型也会参与到信号分子和通路转导中,从而诱发炎症或引发机体免疫反应。同时,Cslow肿瘤则具有与癌症生长及进展相关的基因表达特征,比如对缺氧的适应、新血管的形成以及促癌症转移的细胞转化的诱导等。
9.Science:意外!控制食欲的肠道激素PYY也在调节真菌微生物组中起着重要作用
doi:10.1126/science.abq3178
肽 YY(peptide YY, PYY)是一种由肠道内分泌细胞产生的激素,已知它能控制食欲。在一项新的研究中,来自美国芝加哥大学的研究人员发现PYY在维持哺乳动物消化系统中的真菌平衡方面也发挥着重要作用。他们指出小肠中称为潘氏细胞(Paneth cell)的特化免疫细胞会表达一种PYY,这种PYY能阻止真菌白色念珠菌(Candida albicans)转化为毒性更强的形式。相关研究结果发表在2023年8月4日的Science期刊上,论文标题为“Peptide YY: A Paneth cell antimicrobial peptide that maintains Candida gut commensalism”。

潘氏细胞中的PYY免疫定位。图片来自Science, 2023, doi:10.1126/science.abq3178。
人们已经知道,PYY 是由肠道内分泌细胞分泌的一种指示饱腹感或动物吃饱的激素。这项新的研究表明PYY还具有抗菌肽(antimicrobial peptide, AMP)的功能,可以有选择性地让白色念珠菌的共生酵母形式蓬勃发展,同时抑制它的更危险的形式。
论文通讯作者、芝加哥大学医学教授Eugene B. Chang 博士说,“我们对我们的微生物组中这些真菌的调控机制知之甚少。我们知道它们存在,但不知道是什么让它们保持对我们健康有益的状态。我们如今认为,我们发现的这种肽实际上对维持真菌在肠道中的共生状态非常重要。”
完整的未经修饰的PYY有36个氨基酸,当潘氏细胞将它分泌到肠道中时,它是一种有效的抗真菌肽。但当肠道内分泌细胞产生PYY时,一种酶会剪掉它的两个氨基酸,将它转化为一种通过血液告诉大脑人体不饿的激素。就像从青蛙身上发现它的功能一样,Chang希望对这种肽的更多研究能带来更多惊喜。
10.Science:震惊!人类STING 竟是一种质子通道,可允许质子从高尔基体中泄漏出来
doi:10.1126/science.adf8974
一种名为 STING 的信号蛋白是人体免疫系统中的关键角色,它能检测细胞内的危险信号,然后激活多种防御机制。STING 主要负责侦测 DNA,这可能预示着外来入侵者(如病毒)或宿主组织或细胞受损。当 STING 检测到这一危险信号时,它会开启至少三种不同的途径---第一种产生干扰素,第二种是非经典自噬(参与细胞成分的回收和病原体的清除),第三种是形成炎性体(一种激活炎症反应的蛋白复合物)。
STING刺激干扰素产生的机制已被充分描述,但人们还不清楚它如何激活其他两种途径。如今,在一项新的研究中,来自美国麻省理工学院和哈佛医学院等研究机构的研究人员发现了 STING 如何激活这两种途径。他们发现人类STING 具有一种令人惊讶的、以前未知的功能:它可以充当离子通道,允许质子从一种称为高尔基体的细胞器中泄漏出来。这使它成为第一种能将危险信号转化为离子流的人类免疫传感器。相关研究结果发表在2023年8月4日的Science期刊上,论文标题为“Human STING is a proton channel”。
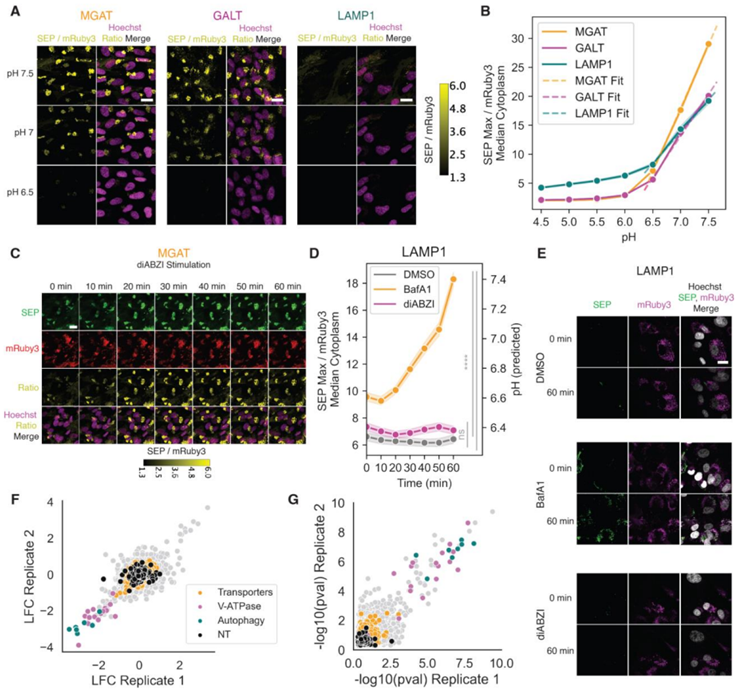
图片来自Science, 2023, doi:10.1126/science.adf8974。
论文共同通讯作者、哈佛医学院医学教授Nir Hacohen说,“要得出 STING 是质子通道的这一新观点,需要将其他实验室之前的发现联系起来,即 STING 或质子通量(proton flux)都能激活炎性体和非经典自噬,这让我们假设 STING 启动或介导质子通量,从而触发这两个下游过程。”
论文共同通讯作者、麻省理工学院科赫综合癌症研究所的Darrell Irvine教授说,“由于它对宿主免疫的重要性,人们对开发能够激活或抑制STING活性的药物非常感兴趣,而STING离子通道活性的发现将为设计调节STING的药物提供新的思路。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


