Cell:开发出利用CRISPR抵抗流感病毒和SARS-CoV-2的新型抗病毒策略
来源:本站原创 2020-04-22 12:48
2020年4月22日讯/生物谷BIOON/---目前,全球正面临着2019年新型冠状病毒病(COVID-19)的大流行,这种疾病由新型冠状病毒SARS-CoV-2(之前称为2019-nCoV)引起,目前尚无针对它的预防性疫苗或行之有效的药物治疗。据预测,研制出安全有效的预防COVID-19的疫苗将需要12到18个月的时间,届时可能有数百万人受到感染。随着全球
2020年4月22日讯/生物谷BIOON/---目前,全球正面临着2019年新型冠状病毒病(COVID-19)的大流行,这种疾病由新型冠状病毒SARS-CoV-2(之前称为2019-nCoV)引起,目前尚无针对它的预防性疫苗或行之有效的药物治疗。据预测,研制出安全有效的预防COVID-19的疫苗将需要12到18个月的时间,届时可能有数百万人受到感染。随着全球范围内的病例和死亡人数迅速增加,面对这种新出现的威胁,人们需要一种灵活而有针对性的保护手段。
由于导致COVID-19、严重急性呼吸综合征(SARS)和中东呼吸综合征(MERS)的冠状病毒都能够从不同的作为病毒库的动物宿主自发地转移到人类身上,因此迫切需要开发出广泛地抵抗未来可能出现的其他冠状病毒的方法。近期的一份报告指出SARS-CoV-2的两种具有不同基因组序列的毒株(L和S)正在传播,并且可能正在进化,这进一步凸显了开发一种泛冠状病毒靶向策略的必要性。
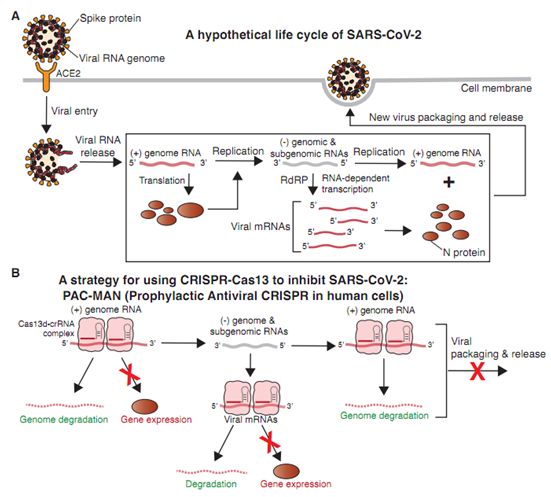
引起COVID-19的新型冠状病毒SARS-CoV-2属于正义RNA病毒家族,通常通过直接的细胞毒性作用和诱导宿主细胞因子介导的炎症来感染上呼吸道和下呼吸道并导致疾病。SARS-CoV-2的生命周期很可能类似于引起SARS的冠状病毒(SARS-CoV):病毒进入细胞,将它的RNA基因组释放到细胞质中,并合成负义基因组RNA和亚基因组RNA,接着基于此合成病毒mRNA和新的正义病毒基因组拷贝(图1A)。
虽然大多数正在进行的疫苗临床试验通过诱导人类免疫系统识别冠状病毒蛋白或减毒病毒并减少病毒进入细胞来发挥作用,但是,在一项新的研究中,来自美国斯坦福大学等多家研究机构的研究人员提出一种替代性抗病毒方法,它依赖于一种基于CRISPR的系统,用于识别和降解细胞内病毒基因组及其产生的病毒mRNA(图1B)。靶向正义基因组和病毒mRNA以同时降解用于病毒复制和基因表达的病毒基因组模板,这将有望稳健地限制病毒复制。相关研究结果以论文手稿的形式在线发表在Cell期刊上,论文标题为“Development of CRISPR as an antiviral strategy to combat SARS-CoV-2 and influenza”。
为了抑制人细胞中的RNA病毒,这些研究人员使用了源自黄化瘤胃球菌(Ruminococcus flavefaciens)XPD3002的第2类VI-D型CRISPR-Cas13d系统,这种系统是最近发现的由RNA进行引导的RNA内切核酸酶。
Cas13d使用CRISPR相关RNA(crRNA),crRNA含有可定制的长22个核苷酸(nt)间隔序列,从而可以将Cas13d蛋白引导到特定的RNA分子上以便进行靶向RNA降解。Cas13d在人细胞中的高催化活性为靶向SARS-CoV-2以进行特异性病毒RNA基因组降解和病毒基因表达抑制提供了一种潜在的机制。由于Cas13d体积小(967个氨基酸)、特异性高、催化活性强,他们选择了Cas13d而不是其他Cas13蛋白来靶向攻击包括SARS-CoV-2和甲型流感病毒(IAV)在内的RNA病毒。虽然这不是第一项使用Cas13变体来靶向人细胞中病毒序列的研究,但是CRISPR工具是否能被设计成有效靶向和切割SARS-CoV-2序列仍是未知数。此外,他们采用的方法与以往的研究不同,他们的目的是开发出一种同时靶向同一病毒家族中的多种病毒的策略,以便提供广泛的泛冠状病毒保护。
在这项新的研究中,这些研究人员在人细胞中开发出一种预防性抗病毒CRISPR策略(Prophylactic Antiviral CRISPR in huMAN cells,简称PAC-MAN)。作为一种基因干预的形式,PAC-MAN靶向SARS-CoV-2和IAV,并且可能靶向所有冠状病毒。他们构建出一种生物信息学管道,在许多测序的SARS-CoV-2基因组中确定高度保守的区域,并利用CRISPR-Cas13d靶向这些保守性区域以进行病毒序列降解。
在提交这篇论文手稿时,这些研究人员无法获得活的SARS-CoV-2毒株。因此,他们使用合成的SARS-CoV-2片段,以及在人肺上皮细胞中使用H1N1 IAV毒株进行活细胞感染来测试他们的方法。他们设计并筛选了多个靶向保守性病毒区域的crRNA文库,并确定了最有效的crRNA。
这些研究人员证实这种方法能够切割SARS-CoV-2片段,并减少人肺上皮细胞中的病毒RNA数量。他们的生物信息学分析揭示出6个crRNA能够靶向91%的已被测序的冠状病毒,以及22个crRNA能够靶向所有已被测序的冠状病毒。通过使用靶向同一病毒的不同区域或者不同冠状病毒毒株的crRNA文库,这种方法可能会对冲病毒进化和逃逸,也可能用来抵御未来出现的相关致病病毒。虽然这一策略在临床上应用之前还有一些障碍需要克服,但PAC-MAN有可能成为一种新的抗病毒策略。
作为一种强大的抗病毒系统,CRISPR-Cas13能够利用序列特异性的crRNA保护宿主细菌细胞免受噬菌体感染。在这项新的研究中,这些研究人员在他们开发的PAC-MAN策略中,重新利用了Cas13d在人细胞中的由RNA引导的RNA内切酶活性来对抗病毒靶标:SARS-CoV-2和IAV。他们证实利用适当设计的crRNA,Cas13d系统可以有效地靶向和切割人肺上皮细胞中的SARS-CoV-2片段和IAV的RNA序列。此外,他们的生物信息学分析表明最少6个crRNA能够靶向91600个IAV毒株中的92%,6个crRNA能够靶向3051个已被测序的冠状病毒中的91%。这将CRISPR-Cas13系统的应用范围扩大到了诊断和活细胞RNA成像之外的领域。
对于SARS-CoV-2和IAV,他们发现了病毒基因组中的高度保守区域可以用Cas13d进行靶向。就SARS-CoV-2而言,这些基因组区域编码对这种冠状病毒的复制和功能至关重要的RNA依赖性RNA聚合酶(RdRP)和核衣壳蛋白(N蛋白)。RdRP负责催化所有病毒mRNA的复制,而N蛋白与基因组RNA结合,保护基因组RNA,并作为病毒颗粒中的两个主要结构蛋白之一。对这些蛋白的靶向抑制,除了通过降解病毒基因组本身降低病毒载量外,还可以在让病毒的产生和功能失效方面发挥着极大的影响。
当靶向IAV时,表现出最佳的病毒抑制效果的crRNA靶向编码神经氨酸酶(NA)的S6节段的保守性末端,其中NA是一种介导新病毒颗粒出芽所必需的病毒表面蛋白。之前的突变分析表明让一个节段末端的包装信号发生突变会导致其他节段的包装减少,这表明IAV基因组的包装存在协作机制。因此,通过抑制单个IAV基因组节段,他们可以以协同的方式降低IAV的整体包装。
值得注意的是,PAC-MAN目前是一种概念验证的抗病毒策略,利用Cas13可以稳健而广泛地靶向保守性病毒序列,在可能治疗COVID-19的临床试验中进行测试之前,还需要采取一些重要的步骤。接下来的一个直接步骤是验证crRNA抑制呼吸道细胞受到活性的SARS-CoV-2病毒感染的效率和特异性。当他们测试PAC-MAN系统作为病毒感染之前的一种预防系统时,他们假设PAC-MAN也可以用来减少感染后的病毒载量,研究这一点也很重要。
在未来的测试中,这种crRNA选择策略可能与最近发表的预测crRNA效率的算法相结合,以便进一步简化crRNA验证过程。被选择用于治疗性测试的crRNA将需要在实验中评估脱靶效应,比如使用全转录组RNA测序进行评估。此外,虽然他们证实PAC-MAN系统能够在体外抑制病毒序列,但是在治疗上的使用将需要一种有效的体内递送方法将它导入到人呼吸道细胞中。最后,PAC-MAN还需要在相关的临床前模型中进行验证,如雪貂或恒河猴或原代人肺/气道类器官,以测试它的抗病毒疗效和特异性。动物模型也将提供与Cas13d诱导的免疫原性相关的信息,这也是CRISPR-Cas9研究中出现的一个问题。包括开展临床试验在内的这些步骤可能需要几年的时间;虽然PAC-MAN无法阻止目前不断上升的COVID-19病例和相关死亡,但它有可能被用于对抗未来的病毒威胁。
在临床上部署PAC-MAN的最大障碍是开发有效和安全的体内递送方法。有几种有吸引力的递送方法可用于PAC-MAN组分的体内表达。Cas13d及其同源的crRNA可以在化学聚合物或脂质纳米颗粒(LNPs)中以RNA形式递送。基于DNA的脂质体递送策略,比如lipitoid或最近开发的HEDGES平台也很有吸引力。另一种策略将是递送含有与crRNA组装在一起的Cas13d蛋白的核糖核蛋白复合物。其他的研究成功地利用工程化的两性肽将Cas9-向导RNA复合物递送到气道上皮细胞,这为递送PAC-MAN Cas13d复合物提供了一种有前景的方法。此外,最近针对囊性纤维化优化的基因治疗递送策略,如可递送mRNA或质粒DNA的自组装肽-poloxamine纳米颗粒,也可能是一种选择。这些研究人员预计,作为抗病毒策略,上述策略中的一种可能通过雾化器系统或鼻腔喷雾剂潜在地在患者或健康人群中施用。
要在临床上使用PAC-MAN,需要克服几个技术限制。其一,PAC-MAN以细胞自主的方式发挥作用,这意味着只有表达Cas13d和crRNA的细胞才能直接抵御靶病毒。要使PAC-MAN对患者有效,它需要在一定比例的细胞中充分表达,这个比例的范围需要通过实验来确定。此外,这项新的研究表明,SARS-CoV-2序列切割效率对crRNA表达很敏感。调节细胞中Cas13d及其同源crRNA的水平的能力可能是实现高效病毒抑制的重要因素。作为另一个考虑因素,由于RNA基因组的二级结构或保护性蛋白的存在,病毒基因组可能不太容易受到抑制。为了解决这个问题,高通量筛选crRNA可能有助于识别出具有高效靶向活性的SARS-CoV-2病毒的crRNA。随着不断进行优化和进一步的测试,这些限制可能被证明是可以克服的。
如果上述障碍被克服,PAC-MAN策略可以被用于治疗性地使用,那么与传统疫苗相比,它具有独特的优势。利用CRISPR-Cas13d实现的潜在泛冠状病毒保护提供了一种针对传统药物或疫苗的替代性和补充性方法。传统的疫苗依赖于通过暴露于病毒蛋白或多肽来刺激免疫系统,不过,这些病毒蛋白或多肽通常来自于具有较高突变率的病毒表面蛋白,这就增加病毒逃避宿主免疫反应的几率。相比之下,这些研究人员们在这项新的研究中展示了一种能够靶向高度保守区域的遗传策略,这将使得病毒通过突变逃避抑制的可能性大大降低。
此外,Cas13d能够从crRNA阵列中处理它自己的crRNA的能力意味着多个靶向不同区域的crRNA可以被同时递送,这会进一步降低了病毒逃逸的机会。作为进一步的优势,他们展示了一种潜在的泛冠状病毒策略,它不仅靶向在人类中传播的病毒,而且还靶向那些在动物病毒库中发现的病毒。如果能在这些病毒感染人类之前,对靶向它们的crRNA进行测试和验证,那么人们就能极大地加快开发出应对未来突发威胁的对策。
总之,PAC-MAN策略代表了一种潜在强大地抑制病毒功能和病毒复制的新方法,这些研究人员们设想它可能被用于靶向一系列正在传播的和新出现的病毒威胁。(生物谷 Bioon.com)
参考资料:
Timothy R. Abbott et al. Development of CRISPR as an antiviral strategy to combat SARS-CoV-2 and influenza. Cell, 2020, doi:10.1016/j.cell.2020.04.020.
由于导致COVID-19、严重急性呼吸综合征(SARS)和中东呼吸综合征(MERS)的冠状病毒都能够从不同的作为病毒库的动物宿主自发地转移到人类身上,因此迫切需要开发出广泛地抵抗未来可能出现的其他冠状病毒的方法。近期的一份报告指出SARS-CoV-2的两种具有不同基因组序列的毒株(L和S)正在传播,并且可能正在进化,这进一步凸显了开发一种泛冠状病毒靶向策略的必要性。
引起COVID-19的新型冠状病毒SARS-CoV-2属于正义RNA病毒家族,通常通过直接的细胞毒性作用和诱导宿主细胞因子介导的炎症来感染上呼吸道和下呼吸道并导致疾病。SARS-CoV-2的生命周期很可能类似于引起SARS的冠状病毒(SARS-CoV):病毒进入细胞,将它的RNA基因组释放到细胞质中,并合成负义基因组RNA和亚基因组RNA,接着基于此合成病毒mRNA和新的正义病毒基因组拷贝(图1A)。
虽然大多数正在进行的疫苗临床试验通过诱导人类免疫系统识别冠状病毒蛋白或减毒病毒并减少病毒进入细胞来发挥作用,但是,在一项新的研究中,来自美国斯坦福大学等多家研究机构的研究人员提出一种替代性抗病毒方法,它依赖于一种基于CRISPR的系统,用于识别和降解细胞内病毒基因组及其产生的病毒mRNA(图1B)。靶向正义基因组和病毒mRNA以同时降解用于病毒复制和基因表达的病毒基因组模板,这将有望稳健地限制病毒复制。相关研究结果以论文手稿的形式在线发表在Cell期刊上,论文标题为“Development of CRISPR as an antiviral strategy to combat SARS-CoV-2 and influenza”。

图1.图片来自Cell, 2020, doi:10.1016/j.cell.2020.04.020。
为了抑制人细胞中的RNA病毒,这些研究人员使用了源自黄化瘤胃球菌(Ruminococcus flavefaciens)XPD3002的第2类VI-D型CRISPR-Cas13d系统,这种系统是最近发现的由RNA进行引导的RNA内切核酸酶。
Cas13d使用CRISPR相关RNA(crRNA),crRNA含有可定制的长22个核苷酸(nt)间隔序列,从而可以将Cas13d蛋白引导到特定的RNA分子上以便进行靶向RNA降解。Cas13d在人细胞中的高催化活性为靶向SARS-CoV-2以进行特异性病毒RNA基因组降解和病毒基因表达抑制提供了一种潜在的机制。由于Cas13d体积小(967个氨基酸)、特异性高、催化活性强,他们选择了Cas13d而不是其他Cas13蛋白来靶向攻击包括SARS-CoV-2和甲型流感病毒(IAV)在内的RNA病毒。虽然这不是第一项使用Cas13变体来靶向人细胞中病毒序列的研究,但是CRISPR工具是否能被设计成有效靶向和切割SARS-CoV-2序列仍是未知数。此外,他们采用的方法与以往的研究不同,他们的目的是开发出一种同时靶向同一病毒家族中的多种病毒的策略,以便提供广泛的泛冠状病毒保护。
在这项新的研究中,这些研究人员在人细胞中开发出一种预防性抗病毒CRISPR策略(Prophylactic Antiviral CRISPR in huMAN cells,简称PAC-MAN)。作为一种基因干预的形式,PAC-MAN靶向SARS-CoV-2和IAV,并且可能靶向所有冠状病毒。他们构建出一种生物信息学管道,在许多测序的SARS-CoV-2基因组中确定高度保守的区域,并利用CRISPR-Cas13d靶向这些保守性区域以进行病毒序列降解。
在提交这篇论文手稿时,这些研究人员无法获得活的SARS-CoV-2毒株。因此,他们使用合成的SARS-CoV-2片段,以及在人肺上皮细胞中使用H1N1 IAV毒株进行活细胞感染来测试他们的方法。他们设计并筛选了多个靶向保守性病毒区域的crRNA文库,并确定了最有效的crRNA。
这些研究人员证实这种方法能够切割SARS-CoV-2片段,并减少人肺上皮细胞中的病毒RNA数量。他们的生物信息学分析揭示出6个crRNA能够靶向91%的已被测序的冠状病毒,以及22个crRNA能够靶向所有已被测序的冠状病毒。通过使用靶向同一病毒的不同区域或者不同冠状病毒毒株的crRNA文库,这种方法可能会对冲病毒进化和逃逸,也可能用来抵御未来出现的相关致病病毒。虽然这一策略在临床上应用之前还有一些障碍需要克服,但PAC-MAN有可能成为一种新的抗病毒策略。
作为一种强大的抗病毒系统,CRISPR-Cas13能够利用序列特异性的crRNA保护宿主细菌细胞免受噬菌体感染。在这项新的研究中,这些研究人员在他们开发的PAC-MAN策略中,重新利用了Cas13d在人细胞中的由RNA引导的RNA内切酶活性来对抗病毒靶标:SARS-CoV-2和IAV。他们证实利用适当设计的crRNA,Cas13d系统可以有效地靶向和切割人肺上皮细胞中的SARS-CoV-2片段和IAV的RNA序列。此外,他们的生物信息学分析表明最少6个crRNA能够靶向91600个IAV毒株中的92%,6个crRNA能够靶向3051个已被测序的冠状病毒中的91%。这将CRISPR-Cas13系统的应用范围扩大到了诊断和活细胞RNA成像之外的领域。
对于SARS-CoV-2和IAV,他们发现了病毒基因组中的高度保守区域可以用Cas13d进行靶向。就SARS-CoV-2而言,这些基因组区域编码对这种冠状病毒的复制和功能至关重要的RNA依赖性RNA聚合酶(RdRP)和核衣壳蛋白(N蛋白)。RdRP负责催化所有病毒mRNA的复制,而N蛋白与基因组RNA结合,保护基因组RNA,并作为病毒颗粒中的两个主要结构蛋白之一。对这些蛋白的靶向抑制,除了通过降解病毒基因组本身降低病毒载量外,还可以在让病毒的产生和功能失效方面发挥着极大的影响。
当靶向IAV时,表现出最佳的病毒抑制效果的crRNA靶向编码神经氨酸酶(NA)的S6节段的保守性末端,其中NA是一种介导新病毒颗粒出芽所必需的病毒表面蛋白。之前的突变分析表明让一个节段末端的包装信号发生突变会导致其他节段的包装减少,这表明IAV基因组的包装存在协作机制。因此,通过抑制单个IAV基因组节段,他们可以以协同的方式降低IAV的整体包装。
值得注意的是,PAC-MAN目前是一种概念验证的抗病毒策略,利用Cas13可以稳健而广泛地靶向保守性病毒序列,在可能治疗COVID-19的临床试验中进行测试之前,还需要采取一些重要的步骤。接下来的一个直接步骤是验证crRNA抑制呼吸道细胞受到活性的SARS-CoV-2病毒感染的效率和特异性。当他们测试PAC-MAN系统作为病毒感染之前的一种预防系统时,他们假设PAC-MAN也可以用来减少感染后的病毒载量,研究这一点也很重要。
在未来的测试中,这种crRNA选择策略可能与最近发表的预测crRNA效率的算法相结合,以便进一步简化crRNA验证过程。被选择用于治疗性测试的crRNA将需要在实验中评估脱靶效应,比如使用全转录组RNA测序进行评估。此外,虽然他们证实PAC-MAN系统能够在体外抑制病毒序列,但是在治疗上的使用将需要一种有效的体内递送方法将它导入到人呼吸道细胞中。最后,PAC-MAN还需要在相关的临床前模型中进行验证,如雪貂或恒河猴或原代人肺/气道类器官,以测试它的抗病毒疗效和特异性。动物模型也将提供与Cas13d诱导的免疫原性相关的信息,这也是CRISPR-Cas9研究中出现的一个问题。包括开展临床试验在内的这些步骤可能需要几年的时间;虽然PAC-MAN无法阻止目前不断上升的COVID-19病例和相关死亡,但它有可能被用于对抗未来的病毒威胁。
在临床上部署PAC-MAN的最大障碍是开发有效和安全的体内递送方法。有几种有吸引力的递送方法可用于PAC-MAN组分的体内表达。Cas13d及其同源的crRNA可以在化学聚合物或脂质纳米颗粒(LNPs)中以RNA形式递送。基于DNA的脂质体递送策略,比如lipitoid或最近开发的HEDGES平台也很有吸引力。另一种策略将是递送含有与crRNA组装在一起的Cas13d蛋白的核糖核蛋白复合物。其他的研究成功地利用工程化的两性肽将Cas9-向导RNA复合物递送到气道上皮细胞,这为递送PAC-MAN Cas13d复合物提供了一种有前景的方法。此外,最近针对囊性纤维化优化的基因治疗递送策略,如可递送mRNA或质粒DNA的自组装肽-poloxamine纳米颗粒,也可能是一种选择。这些研究人员预计,作为抗病毒策略,上述策略中的一种可能通过雾化器系统或鼻腔喷雾剂潜在地在患者或健康人群中施用。
要在临床上使用PAC-MAN,需要克服几个技术限制。其一,PAC-MAN以细胞自主的方式发挥作用,这意味着只有表达Cas13d和crRNA的细胞才能直接抵御靶病毒。要使PAC-MAN对患者有效,它需要在一定比例的细胞中充分表达,这个比例的范围需要通过实验来确定。此外,这项新的研究表明,SARS-CoV-2序列切割效率对crRNA表达很敏感。调节细胞中Cas13d及其同源crRNA的水平的能力可能是实现高效病毒抑制的重要因素。作为另一个考虑因素,由于RNA基因组的二级结构或保护性蛋白的存在,病毒基因组可能不太容易受到抑制。为了解决这个问题,高通量筛选crRNA可能有助于识别出具有高效靶向活性的SARS-CoV-2病毒的crRNA。随着不断进行优化和进一步的测试,这些限制可能被证明是可以克服的。
如果上述障碍被克服,PAC-MAN策略可以被用于治疗性地使用,那么与传统疫苗相比,它具有独特的优势。利用CRISPR-Cas13d实现的潜在泛冠状病毒保护提供了一种针对传统药物或疫苗的替代性和补充性方法。传统的疫苗依赖于通过暴露于病毒蛋白或多肽来刺激免疫系统,不过,这些病毒蛋白或多肽通常来自于具有较高突变率的病毒表面蛋白,这就增加病毒逃避宿主免疫反应的几率。相比之下,这些研究人员们在这项新的研究中展示了一种能够靶向高度保守区域的遗传策略,这将使得病毒通过突变逃避抑制的可能性大大降低。
此外,Cas13d能够从crRNA阵列中处理它自己的crRNA的能力意味着多个靶向不同区域的crRNA可以被同时递送,这会进一步降低了病毒逃逸的机会。作为进一步的优势,他们展示了一种潜在的泛冠状病毒策略,它不仅靶向在人类中传播的病毒,而且还靶向那些在动物病毒库中发现的病毒。如果能在这些病毒感染人类之前,对靶向它们的crRNA进行测试和验证,那么人们就能极大地加快开发出应对未来突发威胁的对策。
总之,PAC-MAN策略代表了一种潜在强大地抑制病毒功能和病毒复制的新方法,这些研究人员们设想它可能被用于靶向一系列正在传播的和新出现的病毒威胁。(生物谷 Bioon.com)
参考资料:
Timothy R. Abbott et al. Development of CRISPR as an antiviral strategy to combat SARS-CoV-2 and influenza. Cell, 2020, doi:10.1016/j.cell.2020.04.020.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


