Developmental Cell:揭示RNA结合蛋白相分离在植物热胁迫应答中的作用
来源:分子植物卓越中心 2022-03-11 08:03
近日,中国科学院分子植物科学卓越创新中心植物逆境生物学研究中心植物分子遗传国家重点实验室张蘅研究组与中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪研究组合作,揭示两个保守RNA结合蛋白质RBGD2(RNA-binding glycine-rich group D 2)、RBGD4通过独特的酪氨酸阵列(Tyr residue a
近日,中国科学院分子植物科学卓越创新中心植物逆境生物学研究中心植物分子遗传国家重点实验室张蘅研究组与中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪研究组合作,揭示两个保守RNA结合蛋白质RBGD2(RNA-binding glycine-rich group D 2)、RBGD4通过独特的酪氨酸阵列(Tyr residue array, TRA)形式诱导蛋白液-液相分离(LLPS,liquid-liquid phase separation),进而达到增强拟南芥耐热性的生理功能。
高温是造成农作物减产的主要逆境之一。作为固着生物,植物进化出了复杂的信号网络来感知环境温度的变化,并可通过多种途径应答热胁迫,例如在转录水平上,热激转录因子HSFA1等可以通过调控众多热响应基因的表达来提高耐热性。热胁迫还能诱导植物产生应激颗粒(stress granule)。应激颗粒是真核细胞应答各种胁迫的一种保守机制,主要由翻译停滞的信使核糖核蛋白(mRNP)组成,此前的研究表明蛋白质的液液相分离在应激颗粒形成中起重要作用,但蛋白质相分离与植物耐热性之间的直接联系尚未有报道。
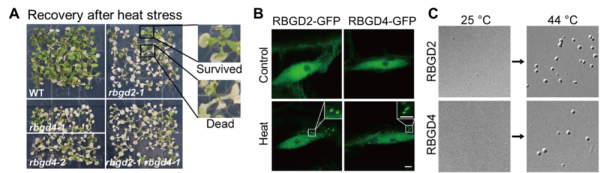
该研究发现RBGD2或RBGD4突变后降低了拟南芥热胁迫后的存活率。正常条件下,RBGD2/4蛋白质弥散的分布于细胞质和细胞核内;热处理后,RBGD2/4在细胞内形成动态的颗粒状结构。纯化的RBGD2/4蛋白质可在体外受温度或溶液环境诱导产生液液相分离,形成动态的液滴状结构。进一步研究发现,RBGD2/4低复杂度结构域(LCD,low-complexity domain)中酪氨酸阵列是驱动RBGD2/4液-液相分离的关键。突变TRA中一半或是全部酪氨酸导致RBGD2/4的体外相分离能力显着降低或缺失,植物细胞内热胁迫诱导产生RBGD2/4颗粒的数目显着降低或消失,并且转基因植物表现出与rbgd2突变体相似的不耐热表型。正常条件下,RBGD2/4蛋白质就与很多应激颗粒组分(如PAB2/4/8)存在相互作用,而热处理显着增加了RBGD2/4结合的蛋白质和信使RNA(mRNA)的数量,其中包括多个热响应转录本(如HSFA2、HSP70)。
该研究揭示了两个新的应激颗粒蛋白质组分RBGD2/4可以通过其TRA响应热胁迫发生液-液相分离,来参与植物热胁迫应答,并建立了RNA结合蛋白的相分离和其热抵抗功能的直接关系,为探索应植物激颗粒的生物学功能提供了新研究对象,同时为提高农作物的耐热性提供了新思路。
相关成果以Liquid-liquid phase separation of RBGD2/4 is required for heat stress resistance in Arabidopsis为题,发表在Developmental Cell上。研究得到中科院战略性先导科技专项,国家重点研发计划和国家自然科学基金委、上海市科委等项目资助。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


