合成聚多肽调控TLR9通路研究取得重大突破
来源:中山大学 2024-09-19 14:57
在胶原性关节炎大鼠模型中,研究证实了这种纳米粒子能够显著抑制关节炎的症状。这一发现深化了我们对阳离子材料抑制自身免疫疾病机制的理解。
近日,中山大学材料科学与工程学院陈永明、刘利新教授团队在国际上第一次阐明了聚合多肽抑制NA激活TLR9的机制,原创性研究论文以“Synthetic polypeptides inhibit nucleic acid-induced inflammation in autoimmune diseases by disrupting multivalent TLR9 binding to LL37-DNA bundles”为题发表于2024年8月19日出版的《Nature Nanotechnology》。
机体异常炎症反应会导致炎症细胞对正常组织持续性浸润、破坏,最终导致多器官功能衰竭、甚至死亡。目前临床治疗药物主要是非甾体抗炎药、糖皮质激素、免疫抑制剂和抗TNF抗体等,存在毒副作用、影响免疫系统、价格昂贵等问题,寻求新的治疗策略是一个重大挑战。
杜克大学Bruce A. Sullenger教授和哥伦比亚大学Kam W. Leong教授等最先提出利用可结合负电游离核酸(cfNA)的阳离子聚合物抑制炎症用于红斑狼疮等疾病治疗的思路(Proc. Natl. Acad. Sci. U. S. A. 2011; Proc. Natl. Acad. Sci. U. S. A. 2016)。近几年,中山大学陈永明教授和刘利新教授证明阳离子聚合物纳米颗粒(cNP)可有效清除NA并缓解类风湿关节炎的症状(Nat. Commun. 2018; Angew. Chem. Int. Ed. 2019,Adv. Funct. Mater. 2020),采用合成模拟DNA酶降解NA达到同样功能(Adv. Funct. Mater. 2023)。进而他们将该思路拓展于银屑病(Sci. Adv. 2020;Biomaterials 2021)、糖尿病足溃疡(Biomacromolecules 2022)和创伤性脑损伤(Biomacromolecules 2023)等炎症疾病。
在自然界中同样存在阳离子多肽如抗菌肽LL37,人类免疫缺陷病毒转录反式激活因子(TAT),不同阳离子多肽与NA结合产生的复合物对于TLR9的作用不同。TAT与NA的复合物抑制TLR9激活,受到TAT富含精氨酸启发,中山大学材料科学与工程学院陈永明、刘利新教授团队设计了纳米聚精氨酸NA清除剂(PEG-TK-NPArg),发现该聚多肽能够有效抑制NA通过TLR9引起的炎症反应。进一步机制研究发现合成的聚多肽不仅能从LL37-NA免疫复合物中竞争结合NA,而且PEG-TK-NPArg-NA复合物中NA的间距与LL37-NA形成的复合物中NA的间距相比,PEG-TK-NPArg显著压缩了DNA链段间的距离,使其不能与TLR9二聚体空腔匹配,无法诱导形成TLR9聚集体,从而阻止了炎症信号的级联放大(图1)。
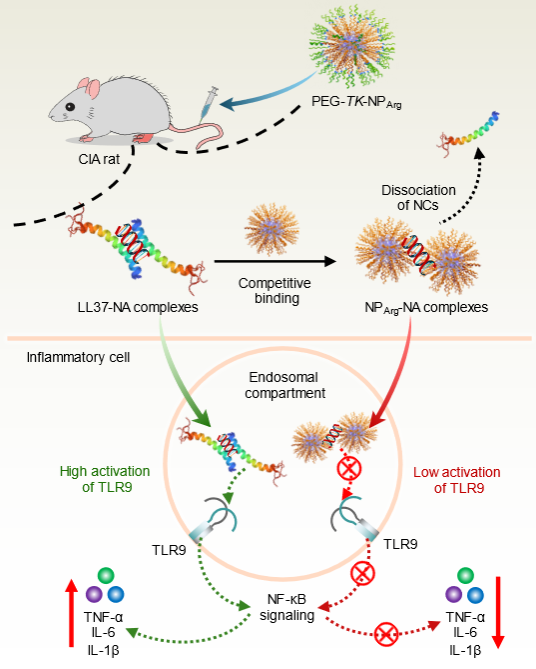
图1.合成聚精氨酸纳米颗粒通过破坏NA与TLR9之间的多价相互作用抑制NA诱导的炎症反应
该研究揭示了阳离子聚精氨酸纳米粒与NA形成复合物中DNA链段间距远小于LL37-NA复合物的,这个变化导致复合物中DNA链段间距不能与TLR9二聚体空腔匹配,不能诱导更多的TLR9聚集及形成下游的信号转导通路放大,从而抑制TLR9的过度激活。在胶原性关节炎大鼠模型中,研究证实了这种纳米粒子能够显著抑制关节炎的症状。这一发现不仅深化了我们对阳离子材料抑制自身免疫疾病机制的理解,而且为开发针对游离核酸相关各种慢性和急性炎症疾病的新型治疗方案提供了有力的科学指导。另外,这种通过材料调控核酸与TLR相关作用的研究还可望为设计更有效安全的新型疫苗佐剂提供借鉴。
该研究工作是由中山大学主持完成的,论文第一作者为中山大学刘兴亮博士研究生,通讯作者为中山大学陈永明教授、刘利新教授和西湖大学张越助理教授。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


