Nat Commun:揭示脂多糖结合蛋白抵御肝脏氧化性压力的分子机制
来源:生物谷原创 2024-05-19 14:44
来自中国科学技术大学等机构的科学家们通过研究识别出了一种机体调节氧化性应激压力的新机制,或能为阐明细胞对氧化性压力产生反应提供新的研究见解。
氧化性压力诱导的脂质积累是脂滴(LDs,lipid droplets)稳态所介导的,其能将脆弱的不饱和甘油三酯隔离在LDs中从而防止进一步过氧化。近日,一篇发表在国际杂志Nature Communications上题为“Lipopolysaccharide binding protein resists hepatic oxidative stress by regulating lipid droplet homeostasis”的研究报告中,来自中国科学技术大学等机构的科学家们通过研究识别出了一种机体调节氧化性应激压力的新机制,或能为阐明细胞对氧化性压力产生反应提供新的研究见解。
衰老和体重增加都会在机体中产生压力,主要表现为过量产生活性氧(ROS),但过度的ROS会导致与机体肥胖和衰老相关的代谢性疾病发生,比如肥胖和脂肪肝等。尽管抗氧化剂和ROS清除剂能减缓机体的代谢功能障碍,但长期的抗氧化疗法或许会产生潜在的安全性问题,目前并没有理想的药物可用,因此,理解氧化性压力所引起的脂质代谢功能异常背后的分子机制就显得尤为重要了。
代谢相关的脂肪肝是一种病理性状况,其主要特征是肝脏中甘油三酯的积累,主要表现为脂滴的积累,脂滴作为纸质储存的主要细胞器,其通常在调节能量代谢上扮演着重要角色。在氧化性压力下,脂滴能积累大量对ROS攻击易感的不饱和脂肪酸甘油三酯(UFA-TG),从而防止进一步过氧化,从而就能维持脂质的稳态,然而,氧化性压力下“氧化性压力躲避”背后的分子机制,目前研究人员并不清楚,而且UFA-TG得细胞分选机制也有待进一步阐明。
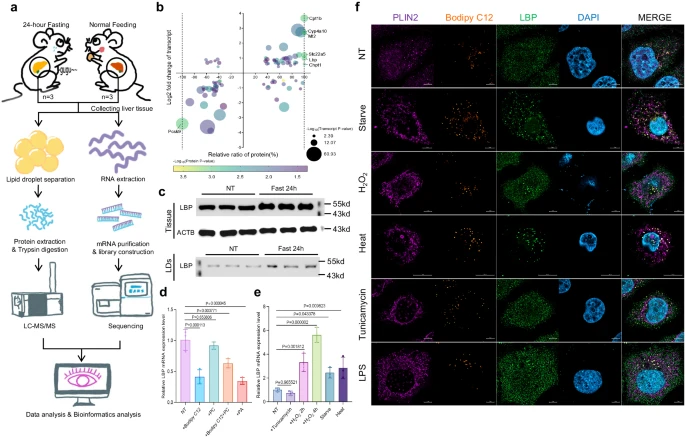
揭示脂多糖结合蛋白抵御肝脏氧化性压力的分子机制
图片来源:Nature Communications (2024). DOI:10.1038/s41467-024-47553-5
当细胞处于氧化性压力下时,脂滴中脂多糖结合蛋白(LBP,lipopolysaccharide-binding protein)的表达水平会升高且会不断聚集;LBP具有脂质可捕获特性,其能通过C端的疏水结构来捕获脂质并将其转运到脂滴中,从而控制脂质氧化的稳态过程。研究人员还发现,利用还原剂N-乙酰-L-半胱氨酸的疗法或能清除细胞内的ROS并增加磷脂的合成,磷脂能与甘油三酯竞争与LBP的结合,从而促进LBP转移到脂滴外部,从而促进脂解过程,然而,在氧化性压力未被消除的环境下,使用磷脂来治疗脂肪肝或许会引起更为严重的肝细胞损伤。
过氧化物酶4(peroxiredoxin 4)能作为细胞氧化还原信号的传感器,其能通过与LBP相互作用来调节LBP/甘油三酯脂滴的穿梭过程,从而维持细胞的氧化还原稳态,此外,长期的压力刺激也会上调LBP的表达,从而导致胰岛素耐受性和肥胖发生。这项研究为开发基于氧化还原稳态调节的新型治疗性策略从而减缓氧化性压力所诱导的代谢功能异常提供了新的线索,并有望为开发代谢性疾病的新型预防措施和疗法提供了新的研究方向。
综上,本文研究结果有望帮助理解LBP在调节脂滴稳态和抵御细胞氧化性损伤中所扮演的关键角色,同时还能指导科学家们开发基于氧化还原的疗法从而减缓氧化性压力所诱导的代谢功能异常。(生物谷Bioon.com)
参考文献:
Zhang, Q., Shen, X., Yuan, X. et al. Lipopolysaccharide binding protein resists hepatic oxidative stress by regulating lipid droplet homeostasis. Nat Commun 15, 3213 (2024). doi:10.1038/s41467-024-47553-5
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


