2021年6月Science期刊不得不看的亮点研究
来源:本站原创 2021-06-30 23:58
2021年6月30日讯/生物谷BIOON/---2021年6月份即将结束了,6月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.Science:揭示中性粒细胞自我限制自身群集反应,从而抑制细菌生长doi:10.1126/science.abe7729; doi:10.1126/science.abj3065中性粒细胞属于我
1.Science:揭示中性粒细胞自我限制自身群集反应,从而抑制细菌生长
doi:10.1126/science.abe7729; doi:10.1126/science.abj3065
中性粒细胞属于我们免疫系统的首批反应者。它们在我们体内循环,在受感染的组织中寻找、杀死和消化有害病原体。为了在发炎组织这一非常复杂的情况下成为如此有效的杀手,它们作为一个集体一起工作。它们释放化学信号,吸引其他细胞形成细胞群体,并作为一个群体进行攻击。
在一项新的研究中,来自德国马克斯-普朗克免疫生物学与表观遗传学研究所的研究人员破译了中性粒细胞群集(neutrophil swarming)的基本生物学特性,并发现这些细胞还进化出一种内在的分子程序来自我限制它们的群集活性。该研究阐明了成群结队的中性粒细胞是如何对自己分泌的信号变得不敏感的,而正是这些信号最初让中性粒细胞群集在一起。这一过程对于有效消除组织中的细菌至关重要。相关研究结果发表在2021年6月18日的Science期刊上,论文标题为“Neutrophils self-limit swarming to contain bacterial growth in vivo”。
在炎症和感染研究领域,中性粒细胞群集仍然是一个相对新颖的话题,其基本机制刚刚开始被探究。Lämmermann实验室的这项新研究如今揭示了中性粒细胞如何在被细菌感染的组织中自我限制它们的群集行为,从而平衡寻找阶段与破坏阶段,以有效地消除病原体。 通过使用专门的显微镜对活体小鼠组织中的免疫细胞动态进行实时可视化观察,Lämmermann及其团队证实,群集的中性粒细胞通过一种称为GPCR脱敏(GPCR desensitization)的过程对它们自己分泌的最初启动这种群集行为的信号不敏感。Lämmermann)说,“我们在中性粒细胞中发现了一种分子终止(molecular break)机制:一旦它们感觉到较大的中性粒细胞群体中积累的高浓度群集吸引物(swarm attractant,即吸引细胞群集在一起的化学物:LTB4和CXCL2),就会停止它们的运动。这令人惊讶,因为普遍的观点认为,在炎症的消退阶段,从组织环境中释放的外部信号对停止中性粒细胞的活动至关重要。”
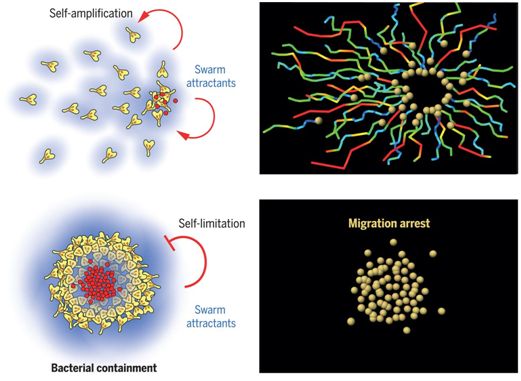
中性粒细胞群体的自组织过程,图片来自Science, 2021, doi:10.1126/science.abe7729。
2.Science:新研究发现151个基因组区域影响人类白质微结构
doi:10.1126/science.abf3736; doi:10.1126/science.abj1881
人脑中的白质在组装分布式神经网络中起着关键作用。磁共振弥散成像(diffusion magnetic resonance imaging, dMRI)使得研究体内白质成为可能,据此发现白质微结构(white matter microstructure)的个体间差异与各种临床结果有关。尽管已知一般人群中的白质差异是可遗传的,但影响白质微结构的常见遗传变异却很少被发现。
在一项新的研究中,为了鉴定出影响白质微结构的遗传变异,来自美国和丹麦的研究人员对五个数据资源中43802人的dMRI数据进行了全基因组关联研究(GWAS)。他们沿着21条脑白质纤维束分析了五种主要的弥散张量成像(diffusion tensor imaging, DTI)模型衍生的参数。相关研究结果发表在2021年6月18日的Science期刊上,论文标题为“Common genetic variation influencing human white matter microstructure”。
在对34024名英国血统的个体进行的GWAS发现中,这些作者复制了以前最大的GWAS中发现的44个基因组区域中的42个,并发现了109个与白质微结构相关的额外区域(P < 2.3×10-10,根据研究的表型数量进行调整)。这些结果表明白质微结构受到多基因的强烈影响。在151个基因组区域中,有52个在他们对9个独立验证数据集的分析中达到了Bonferroni显著性水平(P <5×10-5),其中的4个独立验证数据集针对非欧洲血统的受试者。平均而言,常见的遗传变异解释了白质微结构变异的41%(标准误差=2%)。151个确定的基因组区域可以解释白质微结构32.3%的遗传性,而以前确定的44个基因组区域只能解释11.7%的遗传性。作为对这些GWAS发现的生物学验证,这些作者观察到少突胶质细胞和其他胶质细胞中活跃的调控元件内的遗传性富集,而在神经元中没有观察到这样的遗传性富集。这些结果表明遗传变异通过影响胶质细胞的基因调控而导致白质微结构变化。
这些作者观察到白质微结构与一系列大脑相关的复杂特征和疾病(如认知功能、心血管风险因素以及各种神经疾病和精神疾病)的遗传相关性和共区域化(colocalization)。例如,在报道的25个胶质瘤遗传风险区域中,有11个也与白质微结构相关,这说明胶质瘤和白质完整性之间的密切遗传关系。此外,他们发现14个白质微结构相关基因(P <1.2 ×10-8)是79种常用神经系统药物(如抗精神病药、抗抑郁药、抗惊厥药以及治疗帕金森病和痴呆的药物)的靶点。
3.Science:中美科学家揭示耶尔森菌感染诱导宿主细胞焦亡机制
doi:10.1126/science.abg0269
致病菌采用了多种策略来破坏宿主的先天免疫信号以促进其感染。以前的研究显示,耶尔森菌效应蛋白YopJ靶向并抑制TAK1(transforming growth factor-β–activated kinase 1, 转化生长因子-β活化激酶1)以阻止促炎性细胞因子的产生。为了反击,宿主细胞通过启动RIPK1(receptor-interacting serine/threonine-protein kinase 1, 受体相互作用丝氨酸/苏氨酸蛋白激酶1)依赖性的caspase-8引导的gasdermin D(GSDMD)裂解而触发细胞焦亡(pyroptosis)。然而,RIPK1-caspase-8-GSDMD轴在耶尔森菌感染期间如何被指导仍然是未知的。
在一项新的研究中,来自中国科学院、中国科学院大学、美国波士顿儿童医院和哈佛医学院的研究人员通过无偏见的CRISPR筛选发现了溶酶体膜驻留的Rag-Ragulator复合物在耶尔森菌感染触发的细胞焦亡中的关键和意外作用。相关研究结果发表在2021年6月25日的Science期刊上,论文标题为“The lysosomal Rag-Ragulator complex licenses RIPK1– and caspase-8–mediated pyroptosis by Yersinia”。

在TLR和TNFR连接时,Rag-Ragulator作为一个平台,激活FADD RIPK1 caspase-8复合物,以触发焦亡。图片来自Science, 2021, doi:10.1126/science.abg0269。
这项研究揭示了Rag-Ragulator在耶尔森氏菌感染期间由TAK1抑制诱导的细胞焦亡中的关键作用。Rag-Ragulator在caspase-8介导的细胞焦亡中的新作用证实了它作为监测环境线索的中心枢纽的关键功能,这不仅决定细胞是否增殖,也可以决定细胞是否存活。
4.Science:泛素化对于热休克后细胞活性的恢复至关重要
doi:10.1126/science.abc3593; doi:10.1126/science.abj2400
为了应对许多类型的应激,真核细胞启动了一种适应性的和可逆的反应,包括下调关键的细胞活动,同时将细胞质中的mRNA封存到称为应激颗粒(stress granule)的结构中。伴随着这些应激反应的是泛素化的全局性增加,传统上人们认为这种情形是由于需要降解错误折叠或受损的蛋白质。然而,人们还没有详细表征泛素组(ubiquitinome)如何在应激反应中被重塑。此外,目前还不清楚应激依赖性的泛素化是否在更大的应激反应中发挥了更复杂的作用,而不仅仅是其已知的靶向危险蛋白使其遭受蛋白酶体降解的保护功能。
为了探索泛素化在应激反应中的作用,来自美国圣犹大儿童研究医院的研究人员在一项新的研究中,使用串联泛素结合实体(tandem ubiquitin binding entity, TUBE)蛋白质组学研究了体外培养的哺乳动物细胞(包括人类诱导多能干细胞(ipsC)衍生的神经元)对五种不同类型的应激反应中发生的泛素化变化。这种意料之外的泛素化模式的发现,促使这些作者通过使用diGly泛素残余物分析和串联质谱标签定量蛋白质组学,并结合额外的总蛋白质组和转录组分析,详细分析了热休克特异性诱导的泛素化模式。从这种新定义的“热休克泛素组(heat shock ubiquitinome)”中得到的新见解可指导随后对这种翻译后修饰在细胞对热休克反应中的功能重要性的调查。相关研究结果发表在2021年6月25日的Science期刊上,论文标题为“Ubiquitination is essential for recovery of cellular activities after heat shock”。
这五种不同类型的应激都诱发了独特的泛素化模式。人类人胚胎肾293T细胞中的热休克泛素组是由在应激过程中下调细胞活动(如翻译和核质运输)的特定蛋白质的泛素化定义的,这种模式在U2OS细胞、原代小鼠神经元和人类ipsC衍生的神经元中相似。热休克泛素组也富集于应激颗粒的蛋白质成分中。令人惊讶的是,这种应激诱导的泛素化对于应激颗粒的形成和细胞通路的关闭是非必要的;相反,一旦从应激中恢复过来,热休克诱导的泛素化是p97/含缬氨酸蛋白(VCP)介导的应激颗粒分解和恢复包括核质运输和翻译在内的正常细胞活动的先决条件。许多泛素化事件是针对一种或另一种应激的。例如,泛素化对热应激诱导的应激颗粒的分解是必需的,但对氧化(亚砷酸盐)应激诱导的应激颗粒的分解是不需要的。
5.Science:G3BP1泛素化以特定环境的方式介导应激颗粒的分解
doi:10.1126/science.abf6548; doi:10.1126/science.abj2400
应激颗粒是由RNA和蛋白质组成的动态结构,在细胞质中产生以应对各种应激。这些结构通过液-液相分离形成,通常在初始应激(initiating stress)得到缓解后迅速分解。当蛋白质-蛋白质、蛋白质-RNA和RNA-RNA相互作用的总和突破了一个特定的阈值,即渗滤阈值(percolation threshold)时,应激颗粒就会聚集。当超过这个阈值时,单个的蛋白质和RNA分子形成一个跨越系统的网络,将自己从环境中分离出来,形成独特的颗粒。当这种相互作用的网络低于渗滤阈值时,应激颗粒就会分解。对于应激颗粒来说,G3BP1和G3BP2是为建立应激颗粒组装的渗滤阈值提供最大贡献的蛋白质。
尽管在理解应激颗粒组装的分子基础方面已经取得了很大的进展,但对支配其消除的机制却知之甚少。鉴于许多导致神经变性的突变都会导致应激颗粒的清除障碍,这一过程就显得特别有意义。在一篇伴随的报告中发现,当热休克诱导应激颗粒聚集时,G3BP1被泛素化,而当细胞暴露于其他类型的诱导应激颗粒产生的应激因素时,G3BP1没有发生泛素化。这一发现让来自美国圣犹大儿童研究医院的研究人员在一项新的研究中对应激颗粒的分解机制进行了调查。相关研究结果发表在2021年6月25日的Science期刊上,论文标题为“Ubiquitination of G3BP1 mediates stress granule disassembly in a context-specific manner”。
这些作者发现,在体外培养的人类细胞中,应激颗粒的消除是通过两种可能的途径之一完成的:自噬不依赖性解体(autophagy-independent disassembly)或自噬依赖性降解(autophagy-dependent degradation)。应激颗粒的命运取决于它们保持组装的时间。持续性的应激颗粒,如那些因慢性应激或疾病突变产生的应激颗粒通过自噬依赖性降解被消除。相反,短命的应激颗粒则以一种不依赖于自噬的方式发生快速解体,从而允许应激颗粒的成分循环利用。
此外,应激颗粒分解的机制取决于初始应激的性质。这些作者确定了热应激诱导的应激颗粒分解的分子机制,并发现这种泛素依赖的机制是热休克所特有的,而不是其他类型的应激所特有的。在对热休克的反应中,G3BP1的多泛素化使FAF2结合,FAF2是一种与内质网(ER)相关的泛素依赖性分离酶p97/VCP的衔接蛋白。随后G3BP1被VCP从应激颗粒中提取出来,导致应激颗粒解体。VCP的致病突变损害了这种解体机制。
6.Science:揭示MeCP2蛋白结合羟甲基化的CA重复序列,保护CA重复序列免受核小体入侵
doi:10.1126/science.abd5581; doi:10.1126/science.abj5027
雷特综合征(Rett syndrome)是一种严重的神经发育障碍,主要是由基因MeCP2(methyl-CpG-binding protein 2, 甲基CpG结合蛋白2)突变引起。最初,MeCP2被认为是一种重要的脑蛋白,它通过它的甲基结合结构域(MBD)与甲基化的CpG(mCG)结合,起到转录抑制的作用。然而,在早期大脑发育过程中,MeCP2的产后积累与全基因组范围内羟甲基化胞嘧啶(hmC)和甲基化CpA(mCA)的高水平积累同时发生,这表明MeCP2也可能识别并结合含有这些修饰核苷酸的DNA序列。MeCP2同时识别mCA、hmC和mCG的能力导致了关于它在转录调控中的功能的相互矛盾的结论,因为这些胞嘧啶修饰与转录的抑制(mCA和mCG)或激活(hmC)有关。明确确定MeCP2起作用的靶序列将有助于澄清这一问题。
CA重复序列(CAn)占小鼠基因组的约1%,属于微卫星家族。它们广泛分布于整个基因组,并被证明会影响附近基因的转录。法国研究人员的最近数据显示,CAn在多种细胞类型中发生甲基化(mCAn)或羟甲基化(hmCAn)。在寻找能特异性识别和结合这些CA重复序列的蛋白时,他们发现MeCP2可特异性读取CA重复序列。
基于此,他们在一项新的研究中,猜测CAn的甲基化状态对MeCP2的识别和结合至关重要,可能是通过识别CA重复序列中具有不同亲和力的修饰核苷酸,这与它在转录调节中的神经元功能有关。相关研究结果发表在2021年6月25日的Science期刊上,论文标题为“MeCP2 is a microsatellite binding protein that protects CA repeats from nucleosome invasion”。

雷特综合征蛋白MeCP2是一种调控染色质结构的微卫星CA重复序列结合蛋白。图片来自Science, 2021, doi:10.1126/science.abd5581。
这些作者还通过解析出MeCP2与hmCAn结合在一起时的晶体结构,剖析了MeCP2识别羟甲基化CA重复序列的分子基础。这种羟甲基化CA重复序列形成了一种明确确定的DNA形状,其几何形状有很大的改变,包括一个加宽的主槽和负卷参数,精确地位于修饰位点。他们发现,羟甲基化CA重复序列的分子识别是通过Arg133发生的,Arg133是MeCP2的一个关键氨基酸残基,该位点的突变可导致雷特综合征。
7.Science:天文学和病理学的结合可以预测PD-1阻断治疗癌症的有效性
doi:10.1126/science.aba2609
新的疗法已经被设计为刺激宿主的免疫系统来对抗癌症。尽管近期取得了令人振奋的成功,但仍有很大一部分患者对抗PD-1疗法或抗PD-L1疗法没有反应,因此,选择患者的生物标志物来预测预后是非常理想的。美国食品药品管理局(FDA)批准的唯一的抗PD-1或抗PD-L1疗法的组织病理学生物标志物测试是通过免疫组织化学的方式评估PD-L1蛋白的表达。这种方法是单维的,有其局限性。肿瘤微环境(TME)的新特征聚焦于单细胞水平上的多维、空间分辨率的相互作用,这将为治疗反应提供关键的机理见解,并有可能识别出改进的生物标志物用于患者筛选。在一项新的研究中,来自美国约翰霍普金斯大学和耶鲁大学医学院的研究人员使用多光谱方法对肿瘤微环境进行成像,用细胞代替恒星和星系,将为天文学开发的方法和基础设施应用于对来自黑色素瘤患者的样本进行病理学分析。相关研究结果发表在2021年6月11日的Science期刊上,论文标题为“Analysis of multispectral imaging with the AstroPath platform informs efficacy of PD-1 blockade”。
下一代的病理分析将需要能够原位表征特定细胞亚群上的关键分子的共同表达以及肿瘤细胞和多种免疫成分之间的空间关系的平台。为此,这些作者将用于高质量成像和建立关系数据库的天文算法应用于病理样本的多重免疫荧光(multiplex immunofluorescence, mIF)标记,从而促进了对宿主-肿瘤界面的空间分析和免疫结构表征。总的来说,他们在来自98名接受抗PD-1治疗的黑色素瘤患者的肿瘤组织中单独或组合地探索并协调绘制了6种标志物。这个数据集包含大约127400幅由1亿多个单细胞组成的图像马赛克(image mosaics)。这些数据输出与患者的临床结局相联系,以一种与临床相关的方式告知癌症如何逃避免疫系统,并为开发用于精准免疫疗法的生物标志物测试方法提供动力。
这项研究中使用的成像方案被用来解决有关高功率场采样策略对生物标志物性能影响的悬而未决的问题。这种信息随后被用于开发一种独立于操作者的场选择方法。这些图像处理策略也促进了对不同类型细胞的PD-1和PD-L1原位表达强度(阴性、低、中和高水平)的有力评估。因此,通过仅使用六种标志物(PD-1、PD-L1、CD8、FoxP3、CD163和Sox10/S100),他们就能够开发出这些分子的41种表达模式组合,并将相对罕见的细胞(如CD8+FoxP3+细胞)定位到肿瘤基质边界。
8.Science:釜底抽薪!抑制细菌硫化氢产生可阻止抗生素耐受性和抗药性产生
doi:10.1126/science.abd8377; doi:10.1126/science.abj3062
抗生素耐受性(antibiotic tolerance)是细菌在正常致死水平的抗生素下存活的先天能力。在一项新的研究中,来自美国和俄罗斯的研究人员发现信号分子硫化氢(H2S)在抗生素耐受性中起着关键作用。相关研究结果发表在2021年6月11日的Science期刊上,论文标题为“Inhibitors of bacterial H2S biogenesis targeting antibiotic resistance and tolerance”。
这项研究围绕着抗生素耐受性展开。抗生素耐受性与抗生素抗药性(antibiotic resistance)不同。抗生素抗药性指的是细菌物种碰巧获得了一种帮助它们抵抗抗生素治疗的基因变化。在一种防御机制中,具有抗生素耐受性的细菌,也被称为 “存留菌(persister)”,停止繁殖(增殖),减少它们的能量使用(代谢)以在抗生素治疗中生存,但在治疗结束时恢复生长。存留菌在生物膜(生活在坚韧的聚合物基质中的细菌菌落)中大量存在,这进一步阻止了它们的根除。
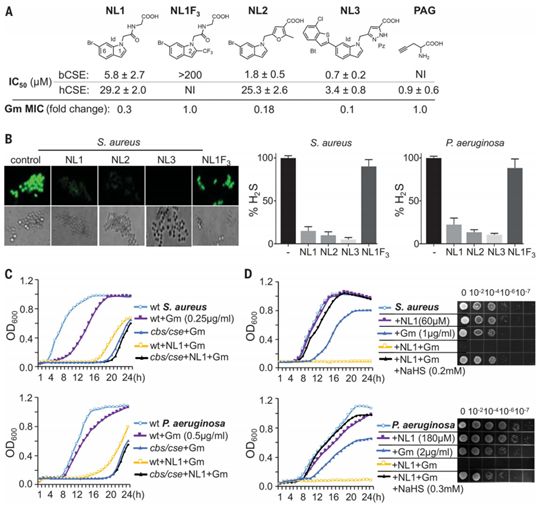
筛选出的细菌CSE抑制剂化学结构及其实验结果,图片来自Science, 2021, doi:10.1126/science.abd8377。
值得注意的是,Nudler团队还已发现这两种病原菌都依赖相同的酶---胱硫醚γ-分解酶(cystathionine γ-lyase, CSE)---来生产大部分的硫化氢。Nudler说,阻断它的作用将是一种破坏抗生素抵御作用的重要方法,但现有的CSE抑制剂对细菌CSE的效力很低,而且很可能在人体组织中引起副作用。
为了找到更好的抑制剂,Nudler团队在这项新的研究中获得了金黄色葡萄球菌CSE的X射线结构,并利用它对数百万种类似药物的化合物进行“虚拟筛选(virtually screen)”,寻找那些具有正确形状和特性的化合物,以阻止该酶的作用而不产生副作用。他们筛选出先导化合物NL1、NL2和NL3:它们能抑制这种细菌CSE,阻止金黄色葡萄球菌和铜绿假单胞菌产生硫化氢,并增强不同类别的杀菌性抗生素的效果。此外,在金黄色葡萄球菌和铜绿假单胞菌感染的小鼠模型中,NL1增加了抗生素杀灭细菌的效力。
9.Science:重写细菌基因组遗传密码的新方法可一次在蛋白中添加多种非天然的氨基酸
doi:10.1126/science.abg3029; doi:10.1126/science.abi9892
几乎所有的有机体都是通过20种不同的氨基酸组合在一起来构建它们的蛋白质。为了在这种组合过程中添加新的氨基酸,科学家们重新设计了基因和其他的蛋白质构建工具,从而产生了具有独特化学特性的对制造药物很有帮助的蛋白质。但是,这类研究工作很费时费力,而且通常一次只能添加一种新的氨基酸。
如今,研究人员打开了做更多事情的闸门。他们近期报告说,对一种细菌的基因组进行广泛的重写,使他们能够在一种蛋白质中添加许多新的氨基酸。这项研究工作可能为合成抗生素和抗肿瘤药物开辟新途径。相关研究结果发表在Science期刊上,论文标题为“Sense codon reassignment enables viral resistance and encoded polymer synthesis”。
通过重写大肠杆菌基因组,研究人员将几种非天然氨基酸整合到细菌蛋白质中。图片来自Steve Gschmeissner/Science Source。
这种重新利用正是Chin和他的同事们如今所完成的。通过研究大肠杆菌菌株Syn61,他们剔除了编码识别UGC和UCA的转移RNA(tRNA)的基因,并将丝氨酸插入延伸中的蛋白质中。他们还移除了对UAG终止密码子产生反应而关闭蛋白质合成的化学化合物。然后,他们将编码新型tRNA的基因添加回来,它们只要遇到UGC、UCA或UAG就会插入非自然氨基酸。最后,他们将这些密码子添加到基因组中他们希望出现非自然氨基酸的地方。他们报告说,这使他们能够在一种蛋白质中一次性添加三种非自然氨基酸。他们还可以在每种蛋白中添加每种非自然氨基酸的多个拷贝。
10.Science:揭示海马体神经回路网络形成中的轴突吸引和排斥机制
doi:10.1126/science.abg1774
我们感知和驾驭世界的能力需要大脑中神经回路的精确组装和功能。在发育过程中,称为轴突的神经元投射在分子线索的引导下,从大脑的非目标区域向它的目标区域延伸,在那里轴突与神经元搭档建立突触连接。在过去的几十年里,科学家们已经鉴定出几种候选的分子线索;然而,对于不同的细胞表面分子集合是否介导了对目标区域的吸引和对非目标区域的回避,仍然存在疑问。在一项新的研究中,来自美国斯坦福大学和哈佛医学院的研究人员在小鼠中发现,轴突吸引和排斥在海马体的神经回路组装过程中由同一个细胞表面分子引导。相关研究结果近期发表在Science期刊上,论文标题为“Reciprocal repulsions instruct the precise assembly of parallel hippocampal networks”。论文第一作者为斯坦福大学的Daniel T. Pederick博士。
海马体含有CA1、CA2和CA3亚区,CA1亚区中的神经元投射到下托中的目标区域。CA1到下托(subiculum)的神经元投射是沿着内侧到外侧的解剖轴组装的。这样,在这种神经回路网络的内侧部分,CA1近端(位于与CA2区域的边界附近)的神经元投射到远端下托(离CA1边界最远的部分),而在这种神经回路网络的外侧部分,CA1远端神经元投射到近端下托。
在这项新的研究中,Pederick等人使用一种叫做单细胞RNA测序的技术来分析发育中的小鼠海马体中单个细胞的基因表达,发现细胞表面蛋白latrophilin 2(Lphn2)在远端CA1神经元投射和外侧海马体神经回路网络的近端下托目标神经元中都有表达。他们最初研究了Lphn2-Lphn2的粘附和吸引是否会以类似于Ten3-Ten3粘附和吸引的方式,指导海马体神经回路的形成。然而,情况并非如此:当这些作者在非粘附性的细胞系中过度表达Lphn2时,这些细胞并没有相互粘附在一起。相反,表达Lphn2的细胞很容易与表达Ten3的细胞形成聚集物,这与以前关于Lphn2与Ten3结合的报道相一致。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


