CAR-T细胞疗法研究进展(第28期)
来源:生物谷原创 2022-05-06 16:07
CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞
CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实 验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产 生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Cancer Cell:CAR-T细胞和阿扎胞苷联手,有望更有效治疗急性骨髓性白血病
doi:10.1016/j.ccell.2022.04.001
急性骨髓性白血病(AML)是成年人中最常见的白血病形式。在一项新的研究中,来自麻省总医院(MGH)的研究人员开发了一种新的治疗策略,涉及使用一种药物以扩大癌细胞表面上的靶抗原数量,以及一种基因改造方法来让T细胞更紧密和持久地附着在这些靶抗原上。它有可能将嵌合抗原受体T细胞(CAR-T)疗法的拯救生命的好处带给AML患者。相关研究结果于2022年4月21日在线发表在Cancer Cell期刊上,论文标题为“Non-cleavable hinge enhances avidity and expansion of CAR-T cells for acute myeloid leukemia”。
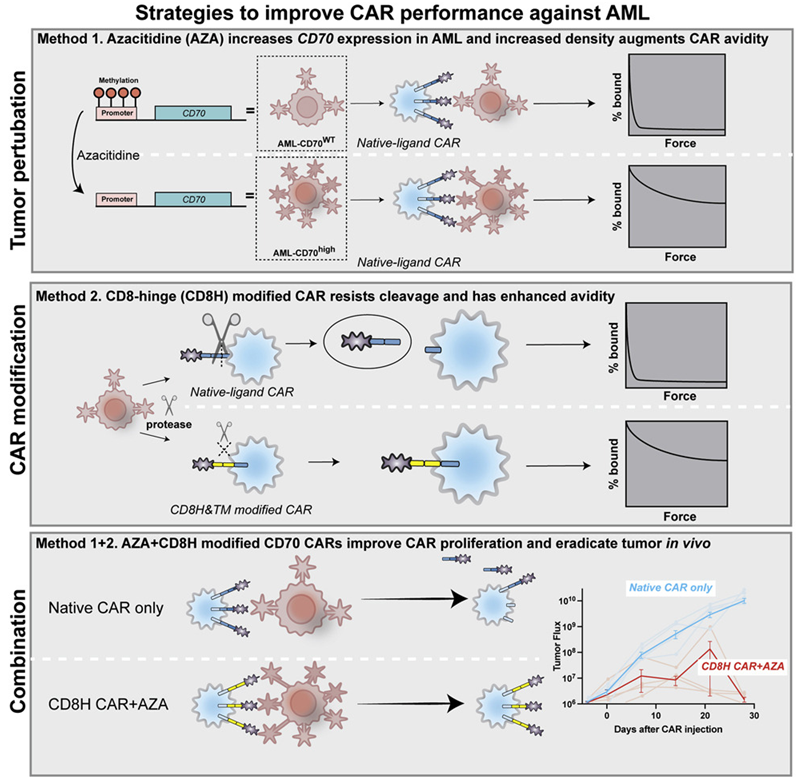
图片来自Cancer Cell, 2022, doi:10.1016/j.ccell.2022.04.001。
以前用CAR-T细胞疗法治疗晚期AML的尝试由于缺乏合适的抗原而受阻,而且当这种治疗杀死大量健康的正常细胞和癌细胞时还会产生“脱靶”效应。论文第一作者、MGH癌症中心细胞免疫疗法项目研究员Mark B. Leick博士与论文通讯作者、MGH癌症中心细胞免疫疗法主任Marcela V. Maus博士及其同事们一起,首先利用靶向CD70抗原的CAR-T细胞(下称 CD70 CAR-T细胞)开始研究,这种抗原在AML细胞上的数量比在正常骨髓细胞上的数量多。在动物模型中,仅使用CD70 CAR-T细胞对AML适度有效,但将它与美国食品药品管理局(FDA)批准的AML药物阿扎胞苷(azacitidine)结合起来,增加了癌细胞表面的CD70抗原数量。他们能够证实通过将这种药物与CD70 CAR-T细胞组合使用,获得了更好的杀伤肿瘤细胞的效果。
此外,与大多数使用来自小鼠的可能会引起不必要的免疫反应的抗体来靶向靶抗原的CAR不同,这项研究中使用的CAR依靠一种称为配体的天然分子与抗原紧密结合,从而避免了免疫系统将杀伤肿瘤的CAR-T细胞识别为外来物并试图排斥它的可能性。
最后,他们克服了一个困扰靶向杀死AML的旧版CAR-T细胞的问题。Leick说,“AML细胞会分泌一种酶,而且是一种蛋白酶,它本质上能够切割CD70 CAR-T细胞,因此我们定位了这种切割发生的位置,并对这个发生切割的区域进行修饰,因此如今CD70 CAR-T细胞与肿瘤结合得更紧密,并更有效地杀死它。”
2.Cell:重磅!下一代更智能的细胞疗法出炉!表达模块化SNIPR受体的CAR-T细胞可高效杀死实体瘤,同时减少毒副作用
doi:10.1016/j.cell.2022.03.023
基于工程化免疫细胞(即经过基因改造的免疫细胞)的疗法最近成为治疗癌症的一种有希望的方法。与传统药物相比,工程化免疫细胞在检测和消除癌细胞的能力方面更加精确和精密。然而,尽管前景广阔,基于细胞的疗法仍然面临重要的限制,包括毒性和它们可能攻击健康细胞的可能性。此外,科学家们并没有很好地掌握如何对现有的治疗性细胞(therapeutic cell)进行基因修饰,以扩它们的应用范围或更好地控制它们的活性。
为了克服这些限制,格拉德斯通研究所和加州大学旧金山分校的研究人员在一项新的研究中对用于设计治疗性细胞的分子构件进行了系统分析。他们的研究为设计具有更高特异性和安全性的治疗性细胞,以及最终定制基于细胞的治疗方法制定了全面的规则手册。相关研究结果发表在2022年4月14日的Cell期刊上,论文标题为“Modular design of synthetic receptors for programmed gene regulation in cell therapies”。
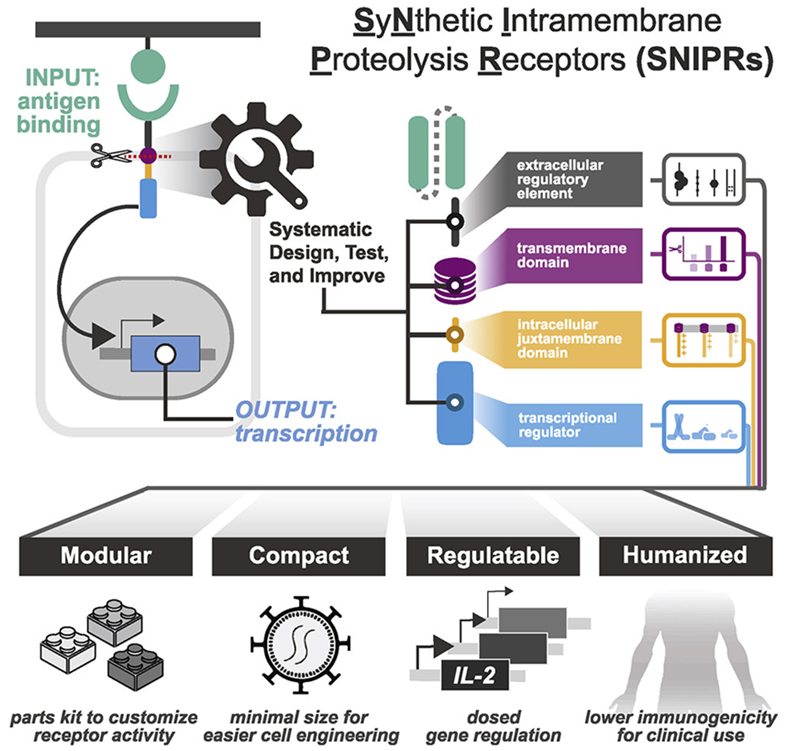
图片来自Cell, 2022, doi:10.1016/j.cell.2022.03.023。
论文通讯作者、加州大学旧金山分校微生物学与免疫学系副教授Kole Roybal博士及其团队构建出一个他们称之为SNIPR(synthetic intramembrane proteolysis receptor,合成膜内蛋白分解受体)的受体的目录,这些受体足够小,可以在人类细胞中进行低成本的工程化。它们也完全由人类受体片段制成,可以检测和响应少量的靶标。此外,SNIPR的活性可以被调整,以便携带它们的细胞不只是杀死靶细胞,而且还可以将特定的分子递送到精确的疾病位置。
这些作者接下来评估了这些优化的受体在白血病、间皮瘤和卵巢癌的小鼠模型中清除肿瘤的能力。为了减少杀死非靶细胞的机会,他们将经设计后用于识别肿瘤表面上的一种分子的SNIPR与经基因改后识别另一种肿瘤分子的CAR受体相结合。此外,他们使CAR受体的产生依赖于SNIPR受体的激活。这样,只有携带synNotch和CAR受体的作用靶标的细胞才会被杀死,而只携带其中的一种作用靶标的细胞则不会被杀死。
3.Science子刊:将溶瘤细胞与CAR-T细胞疗法相结合可改善对实体瘤的治疗
doi:10.1126/scitranslmed.abn2231
在一项新的研究中,来自梅奥诊所的研究人员设计了一种将嵌合抗原受体(CAR)T细胞(CAR-T)疗法与一种溶瘤病毒相结合的免疫治疗技术,更有效地靶向和治疗实体瘤。相关研究结果发表在2022年4月13日的Science Translational Medicine期刊上,论文标题为“Oncolytic virus–mediated expansion of dual-specific CAR T cells improves efficacy against solid tumors in mice”。
这项新的研究表明CAR-T细胞可以将溶瘤病毒递送到实体瘤中。然后,溶瘤病毒可以渗透到肿瘤细胞中,进行复制,使肿瘤细胞爆裂开,并刺激一种强大的免疫反应。
论文通讯作者、梅奥诊所癌症中心基因与病毒治疗项目共同负责人Richard Vile博士解释说,“这种方法允许肿瘤被溶瘤病毒和CAR-T细胞杀死。此外,当溶瘤病毒被递送时,它将肿瘤变成一个极具炎症性的环境,然后患者自身的免疫系统会看到并开始攻击。”
4.Science:通过抓键工程化提高T细胞受体的效力,同时减少脱靶毒性
doi:10.1126/science.abl5282
T细胞受体(TCR)控制T细胞抗原特异性,并在识别肽-主要组织相容性复合体(peptide–major histocompatibility complex, pMHC)时帮助确定反应敏感性。在免疫疗法中,与肿瘤抗原发生反应的TCR用于过继性细胞疗法(ACT)中根除肿瘤,但大多数内源性肿瘤特异性TCR引起的功能反应很弱。为了克服这一限制,肿瘤反应性TCR经历亲和力成熟,以提高其杀伤力。然而,高亲和力的TCR在临床试验中可表现出脱靶毒性,这表明需要新的治疗方法。工程化TCR显示对肿瘤靶标的高效力,同时保留较低的生理亲和力,有可能提高T细胞疗法的疗效,而不增加脱靶副作用的风险。抓键(catch bond)在不断增加的作用力下延长了蛋白之间的结合寿命,从而在pMHC接触时触发TCR激活。然而,抓键是否可以被设计来提高TCR的效力,以及这类TCR是否会保留其天然的特异性和亲和力,目前还不清楚。
在一项新的研究中,来自斯坦福大学和犹他大学等研究机构的研究人员提出需要一种替代亲和力成熟的策略来赋予临床上有用的高效力但低亲和力的TCR[即三维结合亲和力(KD)为~5至50μM]。因此,他们设计了一种称为“抓键搜寻(catch bond fishing)”的工程化策略,它依赖于一种功能选择来招募反应性差的TCR和pMHC之间的抓键。他们推测,通过将某些TCR残基突变成由带电荷或极性氨基酸组成的小文库,然后筛选高效力、低亲和力的TCR变体,可以获得新的抓键。相关研究结果发表在2022年4月8日的Science期刊上,论文标题为“Tuning T cell receptor sensitivity through catch bond engineering”。
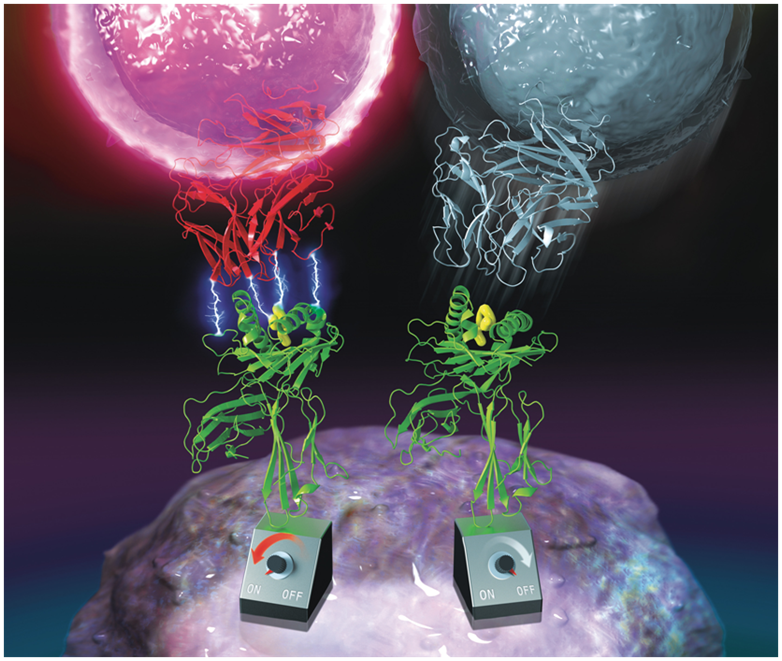
TCR抓键工程化。一种工程化TCR(左,红色)具有pMHC和TCR之间闪电般的捕获键,与不产生信号传导的野生型TCR(右,蓝色)相比,可以触发更强的T细胞信号传导。图片来自Science, 2022, doi:10.1126/science.abl5282。
这些作者首先将这一工程化策略应用于HIV肽特异性人类TCR(TCR55),TCR55以生理上的三维结合亲和力结合人类淋巴细胞抗原B35(HLA-B35)-HIV复合物,但由于在细胞上明显缺乏抓键的形成,正如生物膜力探针(biomembrane force probe, BFP)所测量的那样,未能激活下游的信号传导。他们的功能选择分离出了CD69高表达和pMHC四聚体染色低的T细胞,从而富集了在低亲和力下触发的抓键工程化TCR(即获得抓键的工程化TCR)。TCR55的α和β链上的单个氨基酸位置是抓键热点,在这些位置上的几个氨基酸替换导致强大的信号传导,尽管保留了生理上的三维结合亲和力。根据细胞上的BFP检测,这些具有信号传导活性的TCR变体获得了抓键,它们较长的结合寿命与信号强度相关。
这些作者接下来将这种抓键工程化策略应用于黑色素瘤抗原MAGE-A3特异性TCR。这种TCR的亲和力成熟版本TCR-A3A,以前曾被用于临床试验,由于HLA-A2呈现来自心血管组织衍生的TITIN分子的肽而引起的脱靶毒性,导致患者死亡。他们分离出几个高效力、低亲和力的亲本TCR变体,它们能以生理亲和力(KD为大约10~50μM)促进杀伤MAGE-A3阳性的癌细胞系。此外,这些抓键工程化TCR变体与表达TITIN肽的细胞没有明显的交叉反应。他们使用一个酵母展示的HLA-A1肽文库来筛选抓键工程化TCR变体的交叉反应性。他们发现,预测的人类自我抗原的交叉反应性与它们的亲和力成熟的TCR-A3A对应物相比,可忽略不计。
5.Science子刊:利用水凝胶递送CAR-T细胞可改善对实体瘤的治疗
doi:10.1126/sciadv.abn8264
当前,一种令科学家们兴奋的前沿癌症治疗方法涉及收集和重编程患者的T细胞---一组特殊的免疫细胞---然后将它们灌注会相同的患者体内,准备检测和摧毁癌细胞。尽管这种方法对诸如白血病之类的一系列血癌很有效,但在治疗实体瘤方面却很少成功。
如今,在一项新的研究中,来自斯坦福大学的研究人员开发出一种增强经过基因修饰的免疫细胞---称为嵌合抗原受体(CAR)T细胞(CAR-T)---的“攻击力”的递送方法。他们将CAR-T细胞和专门的信号蛋白添加到水凝胶---一种充满水的凝胶,具有与生物组织相同的特征---中,然后将水凝胶注射到肿瘤旁边。这种水凝胶在体内提供了一种临时的炎性微环境(inflammatory niche),在那里,CAR-T细胞增殖和激活以准备对抗癌细胞。这种水凝胶就像漏水的握笔,泵出激活的CAR-T细胞,以便随着时间的推移不断攻击肿瘤。相关研究结果发表在2022年4月8日的Science Advances期刊上,论文标题为“Delivery of CAR-T cells in a transient injectable stimulatory hydrogel niche improves treatment of solid tumors”。
论文共同通讯作者、斯坦福大学材料科学与工程系助理教授Eric Appel说,“CAR-T细胞领域的很多研究工作都集中在如何制造更好的细胞本身,但对如何使细胞在体内更有效却关注得很少。因此,我们所做的完全是对设计更好细胞的所有努力的补充。”
6.Nature子刊:新方法将制造CAR-T细胞的时间从三天减少到24小时内
doi:10.1038/s41551-021-00842-6
在CAR-T细胞疗法中,科学家们提取出患者体内的T细胞并对它们进行基因改造使之表达特异性识别肿瘤抗原的嵌合抗原受体(CAR)从而制造出CAR-T细胞,然后将这些CAR-T细胞输注回相同患者体内,让它们寻找和攻击癌症。在一项新的临床前研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员开发出一种的新方法有望将制造CAR-T细胞用于治疗癌症患者所需的时间缩短。利用这种方法,他们在短短24小时内制造出具有增强抗肿瘤效力的功能性CAR-T细胞。这些结果表明制造CAR-T细胞所需的时间、材料和劳动力有可能大大减少,这对疾病快速进展的患者和资源匮乏的医疗环境特别有利。相关研究结果近期发表在Nature Biomedical Engineering期刊上,论文标题为“Rapid manufacturing of non-activated potent CAR T cells”。论文通讯作者为宾夕法尼亚大学佩雷尔曼医学院细胞免疫治疗中心研究员Michael C. Milone博士和Saba Ghassemi博士。
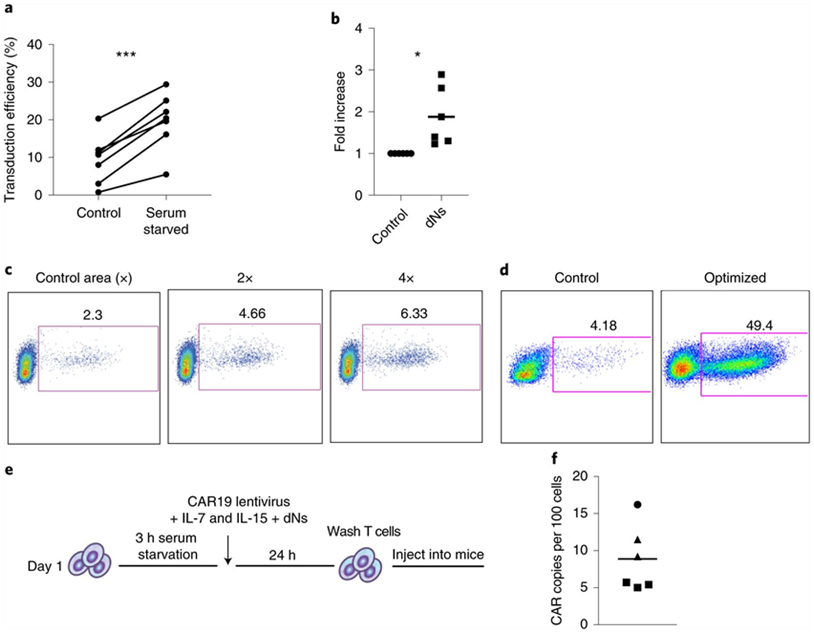
转导条件可以提高非活化T细胞的转导效率。图片来自Nature Biomedical Engineering, 2022, doi:10.1038/s41551-021-00842-6。
Milone说,“虽然用于产生CAR-T细胞的传统制造方法需要几天到几周的时间,但对于白血病等血液癌症患者来说,仍然有很大的需求,以减少产生这些复杂疗法的时间和成本。在我们2018年的研究基础上,将标准制造方法减少到三天,如今减少到24小时以内,这项新研究报告的这种制造方法有潜力改进CAR-T细胞疗法产生的潜力,使更多患者受益。”
传统的制造方法需要刺激或者说激活T细胞,以诱导它们增殖和扩大数量。这些作者开发出的这种新的制造方法的一个关键是将CAR基因递送给T细胞的慢病毒载体。源自人类免疫缺陷病毒(HIV)的慢病毒载体能够将诸如CAR之类的基因转移到细胞中,而不需要这种初始的“激活”步骤,但这个过程的效率很低。他们利用部分上建立在HIV如何天然感染T细胞的知识基础上的基因改造方法,开发出一种克服需要T细胞激活的方法,并将基因直接递送给从血液中新鲜分离出来的未激活的T细胞。这有双重好处:加快了整个制造过程,同时也保持了T细胞的效力。通过这个过程,患者不会被感染HIV。
7.Nat Med:2期临床试验表明CAR-T细胞疗法axi-cel有效治疗高危大B细胞淋巴瘤
doi:10.1038/s41591-022-01731-4
在一项名为ZUMA-12的2期、多中心、单臂临床试验中,来自美国德克萨斯大学MD安德森癌症中心等研究机构的研究人员发现基于嵌合抗原受体(CAR)T细胞疗法axicabtagene ciloleucel(axi-cel)的一线治疗在高危大B细胞淋巴瘤(LBCL)患者中取得了较高的完全缓解率。相关研究结果于2022年3月21日在线发表在Nature Medicine期刊上,论文标题为“Axicabtagene ciloleucel as first-line therapy in high-risk large B-cell lymphoma: the phase 2 ZUMA-12 trial”。这项研究由吉利德公司旗下的Kite Pharma资助。
在接受axi-cel治疗的40名患者中,89%出现客观缓解,78%出现完全反应。12个月的估计总生存率为91%。在数据截止点,中位随访15.9个月后,73%的患者有持续缓解。虽然中位缓解期、无事件生存期和无进展生存期未达到,但是12个月的估计值分别为81%、73%和75%。
论文通讯作者、德克萨斯大学MD安德森癌症中心淋巴瘤与骨髓瘤教授Sattva Neelapu博士说,“现有的LBCL治疗方法包括六个月的化疗。这些新的研究结果提供了证据表明axi-cel可能在一次治疗中提供有效的反应,并消除患者接受其他疗法的需要。”
8.AACR2022:初步临床试验表明CLDN6 CAR-T细胞似乎是安全的,并且显示出早期的疗效
新闻来源:New CAR T-cell Therapy for Solid Tumors Was Safe and Showed Early Efficacy
根据2022年4月8-13日举行的美国癌症研究协会(AACR)2022年年会期间公布的一项I/II期临床试验的初步数据,一种新的嵌合抗原受体(CAR)T细胞(CAR-T)产品具有可接受的安全性,并显示出作为单一疗法以及与mRNA疫苗联合治疗实体瘤患者的早期疗效迹象。
图片来自CC0 Public Domain。
Haanen及其同事们正在进行一项首次人体开放标签的多中心临床试验,以评估先前开发的CAR-T细胞产品的安全性和初步疗效,这种CAR-T细胞产品靶向一种在多种实体瘤中广泛表达但在健康成人组织中沉默的肿瘤特异性抗原,即CLDN6。这种疗法在临床前模型中与有利于CAR-T细胞扩增的编码CLDN6的 mRNA疫苗(CARVac)相结合进行测试。正如Haanen解释的那样,这种称为BNT211的联合治疗导致了转移到患者体内的CAR-T细胞的扩增和血液中更高的持久性,这反过来又改善了它们对肿瘤细胞的杀伤力。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


