BCMAxCD3双特异性抗体!强生teclistamab皮下注射治疗复发/难治多发骨髓瘤:缓解深刻持久,总缓解率65%!
来源:本站原创 2021-05-26 01:12
teclistamab是强生探索多种途径靶向多个靶点治疗多发性骨髓瘤的项目之一。

2021年05月26日讯 /生物谷BIOON/ --强生(JNJ)旗下杨森制药近日公布了通用型T细胞重定向BCMAxCD3双特异性抗体teclistamab(JNJ-64007957,JNJ-7957)I期MajesTEC-1研究(NCT03145181)的最新结果。这是评估teclistamab的首个人体剂量递增研究,在先前已接受过多种方案治疗(heavily-pretreated,过度预治疗)的复发或难治性多发性骨髓瘤(RRMM)患者中开展。
皮下制剂(SC)结果显示,中位随访6个月,在先前已接受疗法中位数为5种的过度预治疗患者队列(n=40)中,在推荐的2期剂量(RP2D)下,teclistamab治疗的总缓解率(ORR)为65%(n=26/40),非常好的部分缓解(VGPR)或更好缓解率为58%,完全缓解率(CR)为40%。随着时间的推移,观察到深刻、持久缓解。同时,teclistamab皮下制剂显示出可控的安全性。
teclistamab是一种以B细胞成熟抗原(BCMA)和T细胞CD3受体为靶点的双特异性抗体。BCMA在多发性骨髓瘤细胞上表达水平显著升高、CD3参与激活T细胞。teclistamab将CD3 T细胞重新定向到表达BCMA的骨髓瘤细胞,以诱导针对靶细胞的细胞毒作用。临床前研究结果表明,teclistamab可杀死来自过度预治疗患者的骨髓瘤细胞。
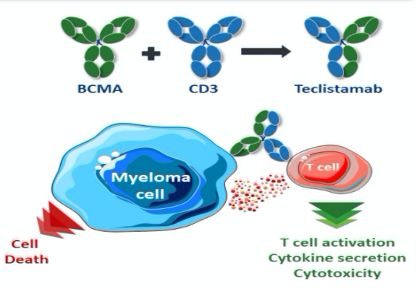
teclistamab作用机制
目前,teclistamab正在I期临床研究中评估治疗复发或难治性多发性骨髓瘤(RRMM)的疗效,同时也在联合研究中进行探索。teclistamab的生产和开发遵循了杨森生物科技公司与Genmab签订的使用DuoBody®技术平台的许可协议。
该项研究的首席调查员、美国希望之城(City of Hope)血液学与造血细胞移植部门多发性骨髓瘤科主任Amrita Y. Krishnan表示:“我们在ASCO 2020年会上报告了teclistamab的初步研究结果,更新的结果已观察到缓解持续加深,有相当比例的患者获得了持久缓解。在整个给药间隔期间,teclistamab持续暴露并超过目标水平,观察到持续的T细胞活化。通过这一最新的随访数据,我们进一步证明了teclistamab在先前接受过多种疗法的患者中具有良好的临床疗效。”
杨森研发公司血液学恶性肿瘤全球主管Yusri Elsayed博士表示:“我们仍然致力于探索在多发性骨髓瘤治疗中使用有前景的治疗方案,包括通用型T细胞重定向双特异性抗体,如teclistamab。此次报告的疗效数据非常令人鼓舞,特别是深度缓解的持久性,支持进一步研究teclistamab作为单药疗法和与其他药物联合使用。尽管多发性骨髓瘤的治疗在过去十年中取得了重大进展,但医疗需求仍然远未满足。这些结果是向前迈出的重要一步,将使我们能够满足这些需求,并可能在未来提供一种有价值的替代治疗选择。”
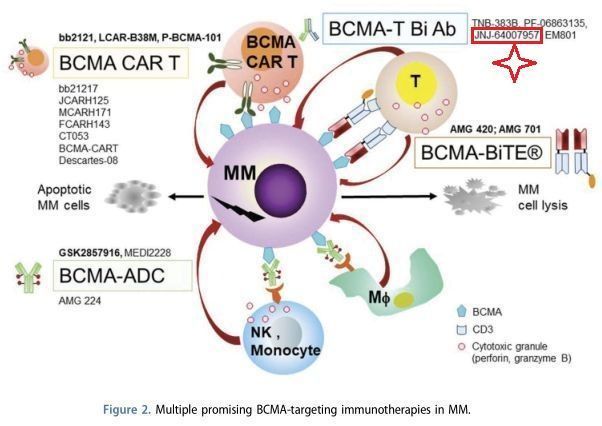
BCMA为靶点的在研MM免疫疗法(来源文献—PMID:31277554)
I期MajesTEC-1研究的主要目的是确定推荐的2期剂量(RP2D,第1部分),并描述teclistamab在RP2D剂量下的安全性和耐受性(第2部分)。截止2021年3月,该研究已入组157例对现有疗法难治、复发、或不耐受的多发性骨髓瘤患者。
此次公布的数据来自40例接受推荐的皮下(SC)RP2D 1500μg/kg治疗的患者。这些患者先前接受过的疗法中位数为5种(范围:2-11种),100%接受过3类疗法(蛋白酶体抑制剂[PI]、免疫调节药物[IMiD]、CD38抗体)、65%(n=26)接受过5种药物(2种PI,2种IMiD,1种CD38抗体)、83%(n=33)为3类难治性、38%(n=15)为5种药物难治性、83%(n=33)的患者对最后一种治疗方案无效。三类疗法难治和五种药物难治的多发性骨髓瘤患者由于治疗方案有限,生存预后很差。
中位随访6个(范围:1.2-12.2个月)的结果显示:在该队列(n=40)中,在SC RP2D为1500μg/kg下,teclistamab治疗的总缓解率(ORR)为65%(n=26/40)。
研究结果表明,随着时间的推移,缓解持续且加深:有58%的患者实现非常好的部分缓解(VGPR)或更好缓解,40%的患者实现完全缓解(CR)或更好缓解。从治疗到首次缓解的中位时间为1个月。中位缓解持续时间(DOR)尚未达到。中位随访7.1个月(范围:3.0-12.2个月)后,DOR仍未达到。病情缓解的患者(n=26)中,有85%(22/26)仍然存活且继续治疗。
在该研究的第1部分中,在teclistamab SC在RP2D剂量下没有剂量限制性毒性。接受RP2D剂量治疗的患者中,报告了一例(1%)1级神经毒性。RP2D剂量下最常见的不良事件为细胞因子释放综合征(70%,均为1/2级)和中性粒细胞减少(65%;40%为3/4级)。
来自该研究的最新安全性、有效性、药代动力学和药效学数据,确认了选择1500ug/kg SC作为teclistamab关键2期注册试验的推荐剂量(RP2D)。(生物谷Bioon.com)
原文出处:Janssen’s Updated Phase 1 Results for Teclistamab Suggest Deep, Durable Responses in Patients with Heavily Pretreated Multiple Myeloma
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


