2023年7月Science期刊精华
来源:生物谷原创 2023-07-31 09:55
2023年7月份即将结束,7月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2023年7月份即将结束,7月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
doi:10.1126/science.abq3061
心房颤动(atrial fibrillation, AFib)是一种常见的心脏疾病,其特点是快速而不规则的跳动,可导致中风和心力衰竭,目前治疗心房颤动的方法有多种副作用,而且无法有效预防心房颤动复发。在一项新的研究中,来自美国麻省总医院(MGH)等研究机构的研究人员发现某些免疫细胞在心房颤动的产生中起着重要作用。因此,靶向这些免疫细胞可能是治疗和预防心房颤动的一种有希望的策略。相关研究结果发表在2023年7月14日的Science期刊上,论文标题为“Recruited macrophages elicit atrial fibrillation”。

SPP1在人非心肌细胞中的表达。图片来自Science, 2023, doi:10.1126/science.abq3061。
在这项新的研究中,论文共同通讯作者、MGH系统生物学中心研究员Matthias Nahrendorf博士及其同事们分析了从心房颤动患者和非心房颤动患者身上采集的心房组织中的细胞。他们的分析结果表明称为巨噬细胞的免疫细胞是心房颤动期间心房组织中最具活力的细胞群体,这些细胞在病变组织中的扩张程度超过了其它任何细胞类型。
这些作者还构建出一种新的心房颤动小鼠模型,他们称之为“HOMER”,并测试了巨噬细胞是否以及如何导致心房颤动。Nahrendorf说,“我们发现,招募的巨噬细胞促进心房中的炎症和纤维化(即瘢痕),这阻碍了心脏细胞之间的电传导并导致心房颤动。抑制巨噬细胞的招募可减少心房颤动。”
基因表达分析表明在人类和小鼠心脏中,SPP1基因在心房颤动期间在巨噬细胞中高度过表达。该基因产生的SPP1蛋白---也叫骨桥蛋白(osteopontin)---可促进组织瘢痕形成,并在心房颤动患者的血液中升高。缺乏这种蛋白的HOMER小鼠的心房巨噬细胞数量减少。
doi:10.1126/science.adg4725
作为美国波士顿大学的分子生物学家和夫妻,Ruslan Afasizhev和Inna Afasizheva已经合作了几十年。他们共同发表了数十篇关于单细胞致病寄生虫---布氏锥虫(Trypanosoma brucei)---线粒体DNA和RNA机制的论文。如今,在一项新的研究中,他们详细介绍了一种叫做RNA编辑的神秘过程,并可能有助于治疗一种致命疾病。相关研究结果发表在2023年7月7日的Science期刊上,论文标题为“Structural basis of gRNA stabilization and mRNA recognition in trypanosomal RNA editing”。
在这篇论文中,Afasizhev和Afasizheva与美国加州大学洛杉矶分校、加州大学欧文分校和中国上海科技大学的合作者一起,首次确定了容纳向导RNA(guide RNA, gRNA)链并允许gRNA链与mRNA接触的分子机器的结构。
确定这些细胞机制可能为科学家们提供治疗非洲昏睡病(一种由布氏锥虫引起的疾病)的重要信息。非洲昏睡病由携带这种寄生虫的采采蝇传播,通常是致命的,许多现有的治疗方法都存在安全隐患,因此分子研究对药物开发尤为重要。
3.Science:新研究发现了使类人猿从以指关节为基础的跳跃转变为人类直立行走的基因变化
doi:10.1126/science.adf8009
灵长类动物进化史上最深刻的进步或许发生在大约 600 万年前,那时我们的祖先开始用两条腿走路。人们认为,向两足行走的逐渐转变使灵长类动物更能适应不同的环境,并解放了它们的双手,使它们能够使用工具,这反过来又加速了认知能力的发展。有了这些变化,现代人类的舞台就搭建好了。
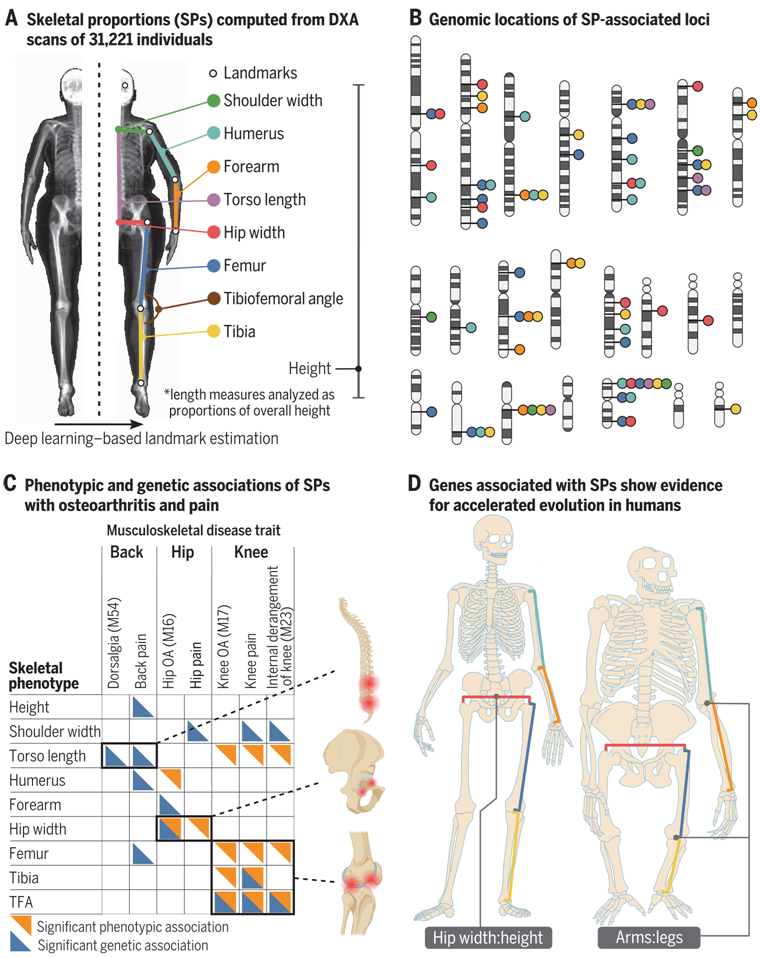
人类骨骼特征的遗传基础、进化和健康后果。图片来自Science, 2023, doi:10.1126/science.adf8009。
在一项新的研究中,来自美国哥伦比亚大学和德克萨斯大学的研究人员发现了使类人猿从以指关节为基础的跳跃转变为人类直立行走的基因变化。他们利用深度学习(人工智能的一种形式)和全基因组关联研究,首次绘制出了灵长类动物骨骼变化导致直立行走的基因组区域图谱。该图谱揭示了化石记录中观察到的解剖结构转变的基因受到了自然选择的强烈影响,并为早期人类带来了进化优势。相关研究结果发表在2023年7月21日的Science期刊上,论文标题为“The genetic architecture and evolution of the human skeletal form”。
论文共同通讯作者、哥伦比亚大学瓦格洛斯内外科医学院计算与统计基因组学(精神病学)助理教授Tarjinder Singh博士说,“在更实际的层面上,我们还发现了与髋关节炎、膝关节炎和背部关节炎相关的基因变异和骨骼特征,这些关节炎是导致美国成年人残疾的主要原因。”
例如,髋关节平均宽高比的轻微偏差与髋关节骨关节炎(hip osteoarthritis)风险的增加有关,而胫骨-股骨角度的轻微偏差与膝关节骨关节炎(knee osteoarthritis)风险的增加有关。这些发现可能有助于科学家们设计出预防和治疗这些使人衰弱的疾病的新方法。
4.Science:重大进展!揭示噬菌体φX174从宿主细胞逃脱机制,有望开发出对抗超级细菌的噬菌体疗法
doi:10.1126/science.adg9091
在COVID-19时代,“病毒”一词让人联想到传染、疾病甚至死亡。但是,如果有一种病毒---一种能够每半小时自我复制数百次的极小病毒---可能能够治愈对所有已知抗生素具有抗药性的严重细菌感染呢?正是这种希望促使美国加州理工学院生化教授Bil Clemons研究这种名为φX174的病毒。
φX174是一种噬菌体:一种感染细菌细胞的病毒。从人类的角度来看,φX174的生活很简单:它找到宿主细菌,停在细菌表面上,将一条DNA链注入细菌细胞,反复复制它的DNA,迫使宿主细胞制造病毒蛋白,将它的DNA和蛋白组装成新的病毒颗粒(噬菌体的拷贝),然后裂开宿主细菌的细胞壁,使得病毒颗粒找到其他宿主进行感染。
在一项新的研究中,Clemons及其研究团队阐明了这种从宿主细胞中逃脱的机制。通过单颗粒电子镜图像,他们发现φX174的E蛋白与宿主细菌的MraY和SlyD蛋白结合形成了一种稳定的复合物---YES复合物。这导致细菌细胞裂解:细菌细胞壁遭受破坏,细菌死亡。相关研究结果发表在2023年7月14日的Science期刊上,论文标题为“The mechanism of the phage-encoded protein antibiotic from ΦX174”。
5.两篇Science论文揭示六聚体核小体激活染色质重塑酶机制
doi:10.1126/science.adf6287; doi:10.1126/science.adf4197
1983年,科学家们发现了六聚体核小体(hexasome)---一种帮助细胞包装DNA的独特分子结构。如今,在一项新的研究中,德国海德堡欧洲分子生物学实验室的Sebastian Eustermann博士及其研究团队揭示了DNA包装到六聚体核小体中如何影响参与基因调控的酶的功能。相关研究结果于2023年6月29日在线发表在Science期刊上,论文标题为“Hexasome-INO80 complex reveals structural basis of noncanonical nucleosome remodeling”。
为了研究这一过程,Eustermann团队广泛使用了低温电镜(cryo-EM),这使他们能够观察与染色质重塑酶结合的六聚体核小体的原子结构。他们发现染色质重塑酶识别并修改了六聚体核小体的结构,这表明这种非经典的核小体结构不仅影响了DNA的包装方式,还影响了酶如何解读染色质中的调控信息。
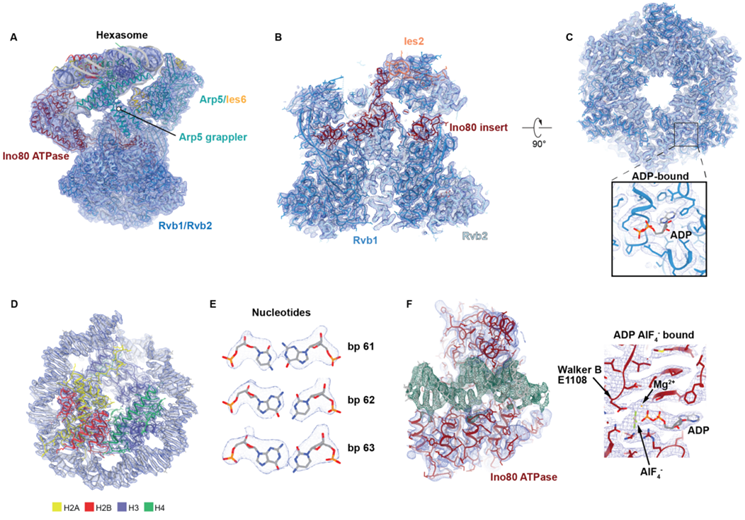
图片来自Science, 2023, doi:10.1126/science.adf6287。
论文第一作者、Eustermann实验室EIPOD博士后Min Zhang说,“我们的研究揭示了六聚体核小体的某些特征如何激活和调控染色质重塑酶。这些有趣的见解可能会激发对细胞核中其他分子机器的研究。六聚体核小体很可能对与癌症密切相关的人类重塑酶产生类似的影响。关于六聚体核小体对基因组调控的后续研究将为基因调控提供新的视角。”
在另一项新的研究中,美国加州大学旧金山分校的Yifan Cheng研究团队和Geeta Narlikar研究团队进一步证实了这一发现,他们从结构上证实了染色质重塑酶在六聚体核小体上被激活,尽管六聚体核小体缺乏以前被认为酶发挥作用所必需的特征。相关研究结果于2023年6月29日在线发表在Science期刊上,论文标题为“Reorientation of INO80 on hexasomes reveals basis for mechanistic versatility”。在早先的一项研究中,Narlikar团队用生化方法证实了六聚体核小体与染色质重塑之间的联系(Molecular Cell, 2022, doi:10.1016/j.molcel.2022.04.026)。
6.Science:通过对杨树进行多重CRISPR基因编辑可实现可持续的纤维生产
doi:10.1126/science.add4514
在一项新的研究中,来自美国北卡罗莱纳州立大学的研究人员利用CRISPR基因编辑系统培育出了木质素(lignin)---它是木纤维可持续产生的主要障碍---含量降低的杨树,同时还改善了它们的木材特性。这些研究结果有望使从纸张到尿布的纤维产生变得更环保、更便宜、更高效。相关研究结果发表在2023年7月14日的Science期刊上,论文标题为“Multiplex CRISPR editing of wood for sustainable fiber production”。
在北卡罗来纳州立大学CRISPR先驱Rodolphe Barrangou和树木遗传学家Jack Wang的领导下,这些作者利用预测建模(predictive modeling)设定了降低杨树木质素水平、提高碳水化合物与木质素(C/L)比率以及增加两种重要木质素构成单元---丁香基(syringyl)和愈创木基(guaiacyl)比率(下称S/G比率)的目标。Barrangou和Wang说,这些综合化学特性代表了纤维产生的化学最佳点。
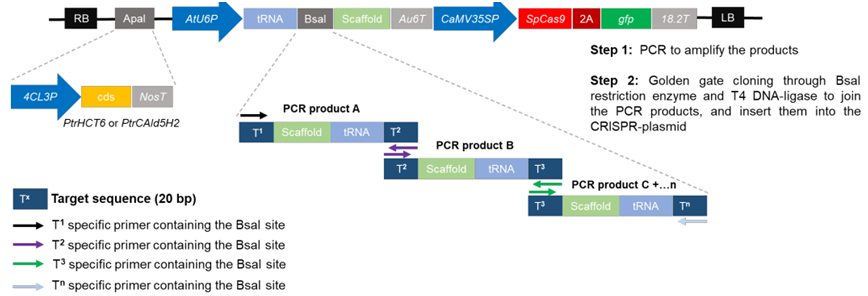
CRISPR构造体组装。图片来自Science, 2023, doi:10.1126/science.add4514。
他们开发的机器学习模型预测并筛选了近7万种不同的基因编辑策略,这些策略靶向21个与木质素产生相关的重要基因---有些策略同时改变多个基因---最终得出347种策略;其中99%以上的策略靶向至少3个基因。
在此基础上,这些作者选出了七种最佳策略,它们的建模结果表明这些策略可以使树木达到化学最佳点---木质素含量比野生树木或未经改造的树木低35%;C/L比比野生树木高200%以上;S/G比比野生树木也高200%以上;树木生长速度与野生树木相似。
根据这七种策略,这些作者利用CRISPR基因编辑技术培育出了174个杨树品系。在北卡罗来纳州立大学的温室中培育6个月后,对这些杨树的检查结果显示,一些品种的木质素含量降低了50%,另一些品种的C/L比值提高了228%。
这些作者说,有趣的是,木质素减少更显著的是接受4至6个基因编辑的树木,尽管接受3个基因编辑的树木木质素减少高达32%。单基因编辑根本无法大幅降低木质素含量,这表明利用CRISPR技术改变多个基因可为纤维产生带来优势。
7.Science:新发现!从癌细胞中消除额外的染色体或能抑制肿瘤的生长!
doi:10.1126/science.adg4521
大多数的癌症都会表现出非整倍性,但其在肿瘤发生中的功能性意义却是颇具争议的;近日,一篇发表在国际杂志Science上题为“Oncogene-like addiction to aneuploidy in human cancers”的研究报告中,来自霍普金斯大学医学院等机构的科学家们通过研究发现,携带额外染色体的癌细胞或会依赖这些染色体来促进肿瘤生长,而消除这些额外的染色体则会预防细胞形成肿瘤,相关研究结果表明,选择性地靶向作用额外的染色体或有望提供一种治疗癌症的新途径。
人类细胞通常携带有23对染色体,额外的染色体则是一种被称为非整倍体的异常现象。研究者Jason Sheltzer教授表示,如果你看一下正常的皮肤或正常的肺部组织,99.9%的细胞都拥有正确的染色体数量,但我们早在100年前就知道,几乎所有的癌症都是非整倍体。然而,目前研究人员并不清楚额外的染色体在癌症发生过程中到底扮演着什么样的角色,比如,是否其会引发癌症或者其是癌症所导致的。
在很长的一段时间里,研究人员都能观察到非整倍体,但却无法对其进行操控,当然研究人员或许只是没有合适的工具对其进行操控;但在这项研究中,研究人员利用基因编辑技术CRISPR开发了一种从癌细胞中消除整个染色体的新方法,这或许是一项重要的技术进展,能以这种方式操控非整倍体染色体或许有望帮助科学家们更深入地理解其背后的功能和重要性。利用研究人员开发的新方法,即利用CRISPR靶向技术恢复非整倍体细胞的二分裂(ReDACT,Restoring Disomy in Aneuploid cells using CRISPR Targeting),研究人员就能靶向作用黑色素瘤、胃癌和卵巢癌细胞系中的非整倍体;具体而言,他们能移除1号染色体q臂的异常第三拷贝,这种拷贝在多种类型的癌症中都被发现了,其与疾病的进展有关,且会在癌症发展的早期发生。
研究者Sheltzer表示,当我们从这些癌细胞的基因组中消除非整倍体时,就会损伤这些细胞的恶变潜能,而且其也会失去形成肿瘤的能力;基于这些研究发现,研究人员认为,癌细胞或许拥有“非整倍体成瘾性”(aneuploidy addiction),这一叫法参考了早期的研究,此前研究人员发现,消除癌基因(能将细胞转变为癌细胞的关键基因)或会破坏癌症的肿瘤形成能力,这一研究发现就促使了一种称之为“癌基因成瘾性”的癌症生长模型的出现。当调查1q染色体的额外拷贝到底是如何促使癌症发生的,研究人员发现,当多个基因被过度表达时,其就会刺激癌细胞生长,因为这些基因会在三条染色体上编码表达,而并非两条典型的染色体。某些基因的过度表达也为研究人员指出了一种能用来靶向作用非整倍性癌症的弱点。
8.Science:重大突破!染色质扩展显微镜技术可解开基因组秘密
doi:10.1126/science.ade5308
开启或关闭基因的能力是我们在细胞、个体甚至在健康和疾病方面观察到的多样性的基础。这个过程被称为基因转录,涉及到将储存在我们的DNA中的信息转化为RNA。
在此之前,科学家们一直依靠不精确的图解和间接的实验来了解这一过程,因为它发生在分子水平上,并不直接可见。然而,在一项新的研究中,一种突破性的显微镜技术如今使得科学家们能够观察到遗传物质内以前不可见的分子过程,为了解基因如何被激活和调节提供了宝贵的见解。相关研究结果发表在2023年7月7日的Science期刊上,论文标题为“Chromatin expansion microscopy reveals nanoscale organization of transcription and chromatin”。
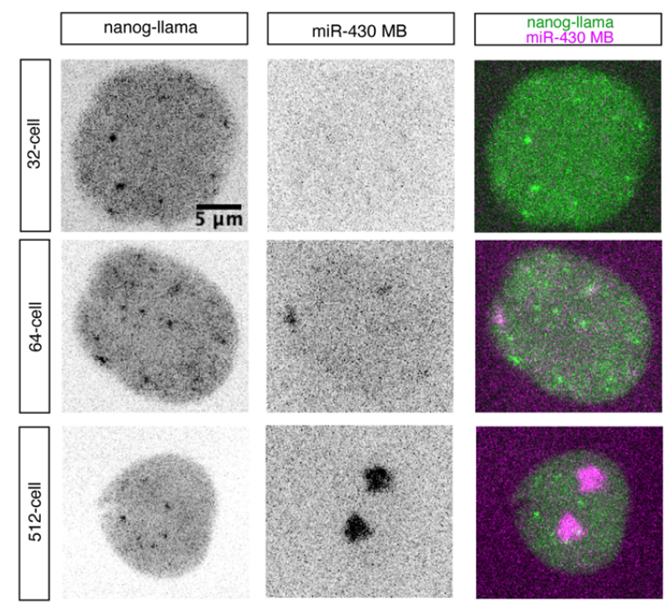
图片来自Science, 2023, doi:10.1126/science.ade5308。
论文共同通讯作者、美国耶鲁大学医学院遗传学教授Antonio Giraldez博士研究了基因组中的DNA代码以及细胞如何解释这些代码以制造胚胎。理解这些过程的一个关键方面涉及我们对基因组进行可视化观察的能力。
不幸的是,传统的显微镜方法有局限性。为了克服这些限制,Giraldez和他的同事们,包括论文第一作者Mark Pownall,与耶鲁大学医学院细胞生物学教授Joerg Bewersdorf博士合作,开发了一种名为染色质扩展显微镜(chromatin expansion microscopy, ChromExM)的新技术。
在这篇论文中,他们利用这种技术成功地将斑马鱼胚胎细胞的细胞核体积增加了4000倍,从而极大地提高了图像分辨率。该技术使得科学家们首次观察到在胚胎发育过程中单个分子如何塑造细胞中的基因表达,并提出了一种关于基因如何受到调节的新模型。
9.Science:新研究在动物中发现介导水平基因转移的载体---病毒样转座子
doi:10.1126/science.ade0705
几十年来,科学家们已经知道基因可以从一种物种转移到另一种物种,无论是动物还是植物。然而,这类看似不可能发生的事件是如何发生的,其机制仍然是未知的。如今,来自奥地利科学院分子生物技术研究所Alejandro Burga实验室的研究人员在线虫中发现了一种水平基因转移(horizontal gene transfer, HGT)的载体。这些发现可能会导致在真核生物中发现更多的HGT载体,并可能在病原体控制中找到应用。相关研究结果发表在2023年6月30日的Science期刊上,论文标题为“Virus-like transposons cross the species barrier and drive the evolution of genetic incompatibilities”。

Mavericks介导不同线虫之间的HGT。图片来自Science, 2023, doi:10.1126/science.ade0705。
生活在北极和南极海洋的鱼类已经进化出巧妙的策略,以防止它们的血液和组织在不适宜居住的极地水域中冻结。其中的一种适应性策略是进化出产生抗冻蛋白的基因。然而,十多年前,科学家们惊奇地发现,鲱鱼和胡瓜鱼---两个完全不同的物种---在它们的基因组中编码了完全相同的防冻蛋白,表明它们之间有基因转移。
诸如此类的例子提出了一个问题:基因如何能在完全不同的物种之间“跳跃”?这种罕见的现象被称为HGT,长期以来一直令进化生物学家感到困惑。尽管多年来在所有的生命分支中都发现了新的HGT实例,但负责这些转移的机制在很大程度上仍然是未知的。
如今,Burga实验室不仅在动物王国中当场抓住了一个HGT事件,而且他们还确定了长期寻找的载体之一。通过基因侦查工作,Burga和他的团队展示了两种生殖隔离的线虫物种之间的HGT事件,这两种物种在基因上的差异就像人类与鱼类一样。更重要的是,他们可以确定这是什么原因造成的:一个叫做Mavericks的病毒样转座子(virus-like transposon)家族。
10.Science:开发出RIBOmap技术,可确定完整组织甚至单个细胞中产生的数千个蛋白的精确位置
doi:10.1126/science.add3067
对于研究蛋白如何导致人类疾病的科学家们来说,准确了解蛋白在细胞和组织内产生的位置可以帮助他们了解它们在疾病中的作用并提出新的治疗方法。
如今,在一项新的研究中,来自美国麻省理工学院和布罗德研究所的研究人员开发出了RIBOmap技术,该技术使他们能够准确定位和可视化观察在完整组织甚至单个细胞中产生的数千个蛋白的精确位置。在庞大的RIBOmap读数中的每一个彩色点代表一个mRNA分子,因为它正在被用来产生相应的蛋白---这一过程被称为翻译。相关研究结果发表在2023年6月30日的Science期刊上,论文标题为“Spatially resolved single-cell translatomics at molecular resolution”。

RIBOmap检测完整脑组织细胞的胞体(蓝色)和突起(红色)中的局部翻译。图片来自Science, 2023, doi:10.1126/science.add3067。
这种方法为科学家们提供了一种方法,以了解单个细胞类型内的翻译是如何被调节的,以及这种调节在疾病中是如何改变的新细节。在这篇论文中,这些作者使用RIBOmap研究了小鼠脑组织中5000多个基因的翻译。他们发现在几种细胞类型中,mRNA的制造地点和相应蛋白的翻译地点之间存在关键差异,这表明细胞以现有转录组学方法(分析mRNA的产生)无法检测的方式调节翻译。
论文通讯作者、麻省理工学院化学助理教授Xiao Wang说,“RIBOmap能以前所未有的分辨率揭示翻译的空间模式。当我们使用RIBOmap来观察组织内的单个细胞时,我们可以开始发现不同的细胞类型是如何以不同的方式调节翻译的。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


