白癜风首个药物疗法!美国FDA批准Opzelura(芦可替尼)乳膏剂:显著改善面部&全身皮损复色!
来源:生物谷原创 2022-07-25 16:41
Opzelura是美国FDA批准的第一种用于治疗白癜风进行皮损复色(repigmentation,色素再沉积)的药物,也是该机构批准的唯一一种JAK抑制剂外用制剂。

图片来源:摄图网
2022年07月25日讯 /生物谷BIOON/ --Incyte公司近日宣布,美国食品和药物管理局(FDA)已批准Opzelura(ruxolitinib,芦可替尼,1.5%乳膏剂)一个新的适应症:该药是一款非甾体、抗炎、外用JAK抑制剂,用于成人和青少年(年龄>12岁)患者,局部治疗非节段型白癜风(nonsegmental vitiligo)。
值得一提的是,Opzelura是美国FDA批准的第一种也是唯一一种用于治疗白癜风进行皮损复色(repigmentation,色素再沉积)的药物,也是该机构批准的唯一一种JAK抑制剂外用制剂。
白癜风是一种慢性自身免疫性疾病,其特征是皮肤色素脱失,这是由产色素细胞——黑素细胞(melanocyte)丢失引起的一种皮肤病,常影响美容美观。JAK信号通路的过度活跃被认为驱动了白癜风发病机制和疾病进展中的所涉及的炎症。白癜风影响全球约0.5%-2.0%的人口。在美国,有超过150万人被诊断为白癜风,总的患病人数估计在200-300万,大多数患者(约85%)患有非节段型白癜风。白癜风可发生在任何年龄,但许多患者会在30岁之前经历初步症状。
ruxolitinib乳膏剂是Incyte公司选择性Janus激酶1和Janus激酶2(JAK1/JAK2)抑制剂ruxolitinib的专利配方制剂,专为局部应用而设计。Incyte拥有开发和商业化ruxolitinib乳膏剂的全球权利,该药开发用于治疗轻度至中度特应性皮炎、用于治疗青少年和成人白癜风。
2021年9月,Opzelura(ruxolitinib乳膏剂)获得美国FDA批准首个适应症:用于短期和非持续性慢性治疗接受外用处方疗法未能充分控制病情或当这些疗法不可取、非免疫功能低下的轻度至中度特应性皮炎(AD)青少年(年龄≥12岁)和成人患者。该药是美国FDA批准的唯一JAK抑制剂外用制剂。研究表明,JAK-STAT通路的失调导致了AD的关键特征,如瘙痒、炎症、皮肤屏障功能障碍。在3期临床研究中,Opzelura治疗显著减少了与AD相关的皮肤炎症和瘙痒。而减少瘙痒可潜在地改善AD患者的关键疾病相关和生活质量结果。
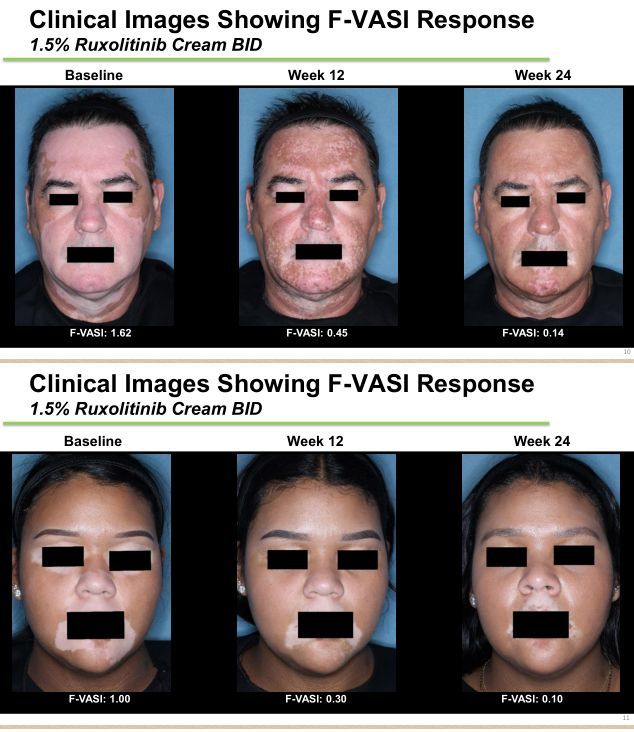
此次白癜风适应症批准,基于关键3期TRuE-V临床试验项目的结果。数据显示,该项目中2项3期临床研究均达到主要终点和关键次要终点:治疗24周后,与赋形剂乳膏剂治疗组相比,ruxolitinib乳膏剂治疗组患者面部和全身皮损复色有显著改善。(具体结果详见:Ph3 Week 24 Vitiligo Oral Presentation (EADV)_Final Draft_9.21.21.pdf)。52周数据表明,随着治疗时间的延长,皮损复色持续改善。该项目中,ruxolitinib乳膏剂没有报告临床上显著的用药部位反应,总体安全性良好。TRuE-V项目的52周数据已在美国皮肤病学会(AAD)2022年年度会议上进行了口头陈述。
TRuE-V项目包括2项3期研究TRuE-V1(NCT04052425)和TRuE-V2(NCT04057573),在青少年和成人(≥12岁)白癜风患者中开展,每项研究入组了大约300例诊断为非节段型白癜风(non-segmental vitiligo,NSV)且有色素脱失区域的患者,目的是评估ruxolitinib乳膏剂作为单药疗法的疗效和安全性。研究中,患者被随机分为2组,接受1.5% ruxolitinib乳膏剂每日2次(BID)或赋形剂对照乳膏剂BID,进行为期24周的双盲期治疗。成功完成基线检查和第24周评估的患者,包括在双盲期接受赋形剂对照乳膏剂的患者,进入扩展期,给予1.5% ruxolitinib乳膏剂BID治疗28周。
结果显示,TRuE-V1和TRuE-V2均达到了主要终点(2项研究均p<0.0001):数据显示,在治疗第24周,与赋形剂对照乳膏剂BID治疗组相比,1.5% ruxolitinib乳膏剂BID治疗组有显著更高比例(TRuE-V1研究:29.9% vs 7.5%;TRuE-V2研究:29.9% vs 12.9%)的患者实现面部白癜风区域评分指数(F-VASI)较基线改善≥75%(F-VASI75)。
此外,这2项研究也达到了关键次要终点,包括:第24周F-VASI较基线改善的百分比,第24周达到F-VASI50(较基线改善≥50%)、F-VASI90(较基线改善≥90%)、全身白癜风区域评分指数(T-VASI)较基线改善≥50%(T-VASI50)的患者比例,第24周达到白癜风显著性量表(VNS)得分为4分(不那么引人注目)或5分(不再引人注目)的患者比例,患者报告结果。ruxolitinib乳膏剂的总体疗效和安全性与之前报道的2期研究数据一致,没有观察到新的安全信号。2项研究的长期疗效和安全性部分将按计划继续进行。
ruxolitinib也是Incyte公司口服药物Jakafi的活性药物成分,该药在美国已批准3个适应症:(1)治疗对巯基尿应答不足或不耐受的的红细胞增多症(PV)成人患者;(2)治疗中高危骨髓纤维化(MF)成人患者,包括原发性MF、PV后MF、原发性血小板增多症后MF;(3)治疗类固醇难治性急性移植物抗宿主病(GVHD)患者。其中,第三个适应症于2019年5月获FDA批准,是首个获批治疗个适应症的药物。Jakafi由Incyte在美国销售,诺华在美国以外市场以Jakavi品牌名销售。
目前,Concert公司也正在开发采用氘化学技术修饰的ruxolitinib分子——CTP-543,在II期临床研究中,治疗斑秃展现出强劲疗效。斑秃是一种自身免疫性疾病,导致局部或完全脱发。ruxolitinib的氘化学修饰可以改变其人体药代动力学,从而增强其作为斑秃治疗的用途。在美国,FDA已授予CTP-543治疗斑秃的快速通道地位。(生物谷Bioon.com)
原文出处:Incyte Announces U.S. FDA Approval of Opzelura? (ruxolitinib) Cream for the Treatment of Vitiligo
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


