Journal for ImmunoTherapy of Cancer:非小细胞肺癌中肿瘤突变负荷、PD-L1表达和免疫治疗结果的癌基因特异性差异
来源:生物谷 2021-08-23 14:03
具有可靶向癌基因改变的非小细胞肺癌(NSCLC)患者通常从免疫检查点阻断(ICB)中获益有限,这归因于低肿瘤突变负荷(TMB)和/或程序性死亡配体-1(PD-L1)水平。
具有可靶向癌基因改变的非小细胞肺癌(NSCLC)患者通常从免疫检查点阻断(ICB)中获益有限,这归因于低肿瘤突变负荷(TMB)和/或程序性死亡配体-1(PD-L1)水平。该研究调查了这些标志物和临床结果的致癌基因特异性差异。
图片来源:http://dx.doi.org/10.1136/jitc-2021-002891
程序性死亡受体-1(PD-1/PD-L1)免疫检查点阻断(ICB)彻底改变了许多癌症类型的治疗,包括NSCLC。ICB有可能引起持久的反应,但单药ICB的反应率仅为15%~20%,已充分证明高PD-L1表达和高肿瘤突变负荷(TMB)与ICB在NSCLC中的优越益处相关,然而,EGFR和ALK 癌基因的驱动改变与“冷”免疫微环境和ICB治疗的不良结果有关。
最近,一项关于IMMUNOTARGET注册的研究表明,携带罕见典型癌基因改变的NSCLC患者对ICB的反应模式不同,这些数据强调了致癌基因改变对ICB反应的关键影响,但由于这些用ICB治疗的罕见癌基因改变的NSCLC的稀缺性,某些癌基因组的患者数量相对较少,无法得出明确的结论。为了填补这一空白,该研究利用了一个由4189名患者组成的大型NSCLC队列,其中包括4017名具有致癌基因改变、TMB和PD-L1数据的NSCLC患者以及两个由1066名接受ICB单药治疗的NSCLC患者组成的大型注册队列,以评估癌基因改变对TMB、PD-L1表达和ICB治疗的临床结果。
单药PD-1/PD-L1免疫检查点抑制剂治疗癌基因驱动的非小细胞肺癌的临床结果 图片来源:http://dx.doi.org/10.1136/jitc-2021-002891
MDACC和CGDB免疫治疗队列的不同治疗组的临床结果 图片来源:http://dx.doi.org/10.1136/jitc-2021-002891
在MDACC队列中,BRAF组在所有基因组组中的无进展生存期(PFS)最长(BRAF 7.4与KRAS 2.8个月,HR 0.36,95% CI 0.14至0.88,p=0.026),而经典EGFR和HER2组具有最短的PFS(分别为1.8和1.9个月),在随后针对PD-L1表达和吸烟状况进行调整的多变量分析中保持相同的趋势(MDACC队列的TMB数据不可用)。与KRAS组相比,BRAF组总生存期(OS)在数值上更长,但差异无统计学意义(35.6 vs 16.8个月,HR 0.65,95% CI[0.26~1.63],p=0.363),同时,经典EGFR突变患者的OS最短(11.3个月,95% CI 5.8 -16.9,HR 2.01,p=0.006)。此外,在所有致癌基因组中,BRAF组的客观缓解率(ORR)也最高(62%)(Fisher精确检验 p<0.001),与常用对照KRAS组相比,这种差异无统计学意义(62% vs 24%,p=0.364)。与MDACC队列的结果一致,CGDB免疫治疗队列在所有基因组中BRAF组在具有最长的PFS(V600E 9.8和非V600E 5.4个月)和OS(V600E 20.8和非V600E 14.9个月),尽管差异未达到统计学差异,同时,经典EGFR 突变患者的PFS显著缩短。与经典EGFR组相似,癌基因融合患者(ALK:n=19;ROS1:n=3;RET:n=14)的预后较差,与KRAS组相比,PFS有缩短的趋势,MET外显子14突变组(n=34)也有2.7个月的短PFS,但与KRAS组相比差异不显著(HR 1.13, 95% CI 0.69 to 1.84, p=0.59)。
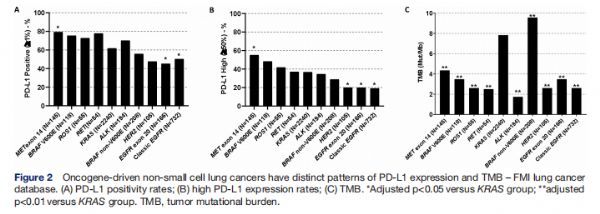
癌基因驱动的非小细胞肺癌具有不同的PD-L1表达模式和TMB-FMI肺癌数据库 图片来源:http://dx.doi.org/10.1136/jitc-2021-002891
研究者利用来自FMI生物标志物队列的4017名NSCLC患者来评估癌基因改变对PD-L1表达和TMB的影响,在MET (115/145, 79.3%)、RET (42/54, 77.8%)、BRAF V600E (89/118, 75.4%)、ROS1 (40 /55, 72.7%)和ALK (136/194, 70.1%)组中观察到PD-L1阳性率高(TPS≥1%),在携带 EGFR外显子20 (75/166, 45.2%)、HER2 (50/105, 47.6%)、经典EGFR(外显子19缺失和外显子21 L858R)(368/732, 50.3%)和BRAF 非-V600E(116/208,55.8%)的肿瘤中观察到低患病率,与KRAS突变的NSCLC相比,MET突变肿瘤具有更高的PD-L1阳性率(TPS≥1%),而EGFR突变肿瘤具有显着较低的PD-L1阳性率,这与研究者之前的研究结果一致。 此外,高PD-L1表达(TPS≥50%)在MET (80/145, 55.2%)、BRAF V600E (57/118, 48.3%)、ROS1融合(23/55, 41.8%)的和RET融合改变(20/54, 37.0%)肿瘤中很常见,其中,携带MET变异的肿瘤PD-L1高表达率(TPS≥50%)显着高于KRAS组,而经典EGFR、EGFR外显子20和HER2组PD-L1高表达率低于KRAS组(成对比较) vs KRAS p<0.050)。与KRAS组相比,BRAF 非-V600E组的TMB更高(9.6 mut/Mb [n=208] vs 7.8 mut/Mb [n=2240];调整后的p=0.003),所有其他致癌基因组的TMB 显著降低(调整后的p<0.001),而ALK (n=194)、经典EGFR (n=732)、HER2(n=105)、RET (n=54) 和ROS1 (n=55)组的TMB最低,中位数<3 mut/Mb。
该研究证明TMB和PD-L1表达对NSCLC中ICB治疗的临床结果的影响,但更具体地说是对致癌基因成瘾的NSCLC人群的影响。此外,BRAF突变的NSCLC具有高TMB 和PD-L1表达,这可能使该组对ICB治疗更敏感,这些结果表明ICB是BRAF突变型 PD-L1+ NSCLC一线治疗的合理选择,因为它有可能带来持久的临床益处。(生物谷 Bioon)
参考文献
Marcelo V Negrao et al. Oncogene-specific differences in tumor mutational burden, PD-L1 expression, and outcomes from immunotherapy in non-small cell lung cancer. Journal for ImmunoTherapy of Cancer (2021 Aug 10) doi:http://dx.doi.org/10.1136/jitc-2021-002891
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。