共生微生物来源的醋酸盐通过小鼠肝脏 FFAR2 信号抑制 NAFLD/NASH 的发展
来源:本站原创 2021-09-29 10:29
非酒精性肝病(NAFLD)是代谢综合征的肝脏表现,可发展为非酒精性脂肪性肝炎(NASH)。肠道微生物组的改变与 NAFLD/NASH 的发展有关,但是其潜在机制尚不清楚。
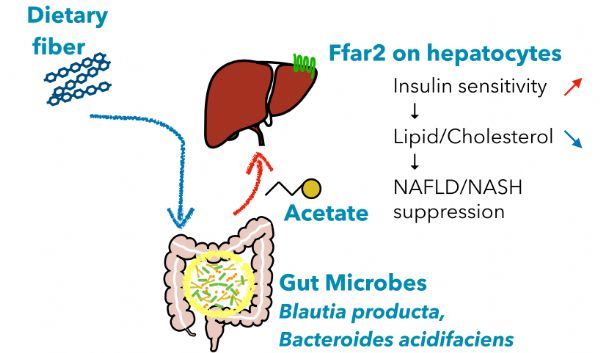
非酒精性肝病(NAFLD)是代谢综合征的肝脏表现,可发展为非酒精性脂肪性肝炎(NASH)。肠道微生物组的改变与 NAFLD/NASH 的发展有关,但是其潜在机制尚不清楚。作者发现益生元菊粉的消耗显着改善了小鼠的 NAFLD/NASH 表型,包括肝脂肪变性和纤维化。 菊粉的消耗导致肠道微生物群的整体变化,包括伴随的拟杆菌属和 Blautia 属的富集,以及肠腔和门静脉血中短链脂肪酸的浓度增加,尤其是醋酸盐。
醋酸释放抗性淀粉的消耗可防止 NAFLD 的发展。酸化拟杆菌在无菌小鼠中的定殖对菊粉的乙酸盐产生产生协同作用。
此外,游离脂肪酸受体 2 (FFAR2)(一种醋酸盐受体)的缺失消除了菊粉的保护作用,更严重的肝肥大、高胆固醇血症和炎症表明了这一点。
图片来源:https://doi.org/10.1186/s40168-021-01125-7
非酒精性脂肪性肝病(NAFLD)与代谢综合征,特别是肥胖、糖尿病和胰岛素抵抗密切相关。NAFLD的特点还包括肝脏中脂质(甘油三酯和胆固醇)沉积增多、肝肿大和血清丙氨酸转氨酶(ALT)活性高。高达25%的NAFLD患者会发展为一种更为严重的疾病,称为非酒精性脂肪性肝炎(NASH),其特征是脂肪变性、炎症、肝细胞膨胀和纤维化。尽管NAFLD的患病率很高,但目前对NAFLD/NASH的治疗往往仅限于减肥和运动,而这往往难以维持。
近年来,多项证据表明,肠道微生物群是NAFLD发展及其进展为NASH的重要环境因素。NAFLD 患者的肠道微生物组表现出结构变化,例如革兰氏阴性菌增加和脂多糖 (LPS) 生物合成的遗传途径。在NASH实验模型中,LPS激活toll样受体并引起肝脏炎症。此外,NAFLD/NASH 患者肠道微生物产生的乙醇更高,NASH 还与胆汁酸、3-(4-羟基苯基)乳酸和苯乙酸的分布变化有关。肠道微生物衍生的丙酸咪唑也会损害肝细胞的葡萄糖耐量和胰岛素抵抗。这些观察表明,肠道微生物的改变可能是NASH发病的重要原因,因此控制肠道微生物群是预防NAFLD/NASH的一种新兴策略。
一些临床研究显示,益生元补充可减少肝脏脂肪生成并抑制人类NAFLD的发展,尽管宿主微生物相互作用影响NASH易感性的分子机制仍有待完全确定。肠道微生物群利用益生元作为发酵源产生各种代谢物,如短链脂肪酸(SCFAs),,特别是丁酸盐,可被结肠上皮有效地用作能量来源。短链脂肪酸还通过增加肠黏膜中的粘蛋白和IgA的产生来增强粘膜屏障功能。此外,n-丁酸盐通过抑制组蛋白去乙酰化酶促进调节性T细胞分化,从而防止肠道炎症。但宿主微生物如何影响 NASH的分子机制仍未完全确定。此外,醋酸盐负调控脂肪细胞中的胰岛素信号,从而抑制脂肪沉积。这些先前的研究表明,益生菌对宿主免疫和代谢的有益作用至少部分是由肠道微生物组衍生的代谢物介导的。
来自碳水化合物发酵的乙酸盐对小鼠 NAFLD/NASH 的保护作用的模型
图片来源:https://doi.org/10.1186/s40168-021-01125-7
来自肠道中益生元发酵的乙酸盐通过肝细胞中的 FFAR2 调节肝脏脂质代谢和胰岛素敏感性,从而抑制 NAFLD/NASH 的进展。该研究结果表明,益生元或醋酸释放抗性淀粉激活肝脏FFAR2可能是NAFLD/ NASH的一种有前景的治疗策略。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。