纵观干细胞临床转化:中国与发达国家的差距及解决方案
来源:本站原创 2019-05-05 10:45
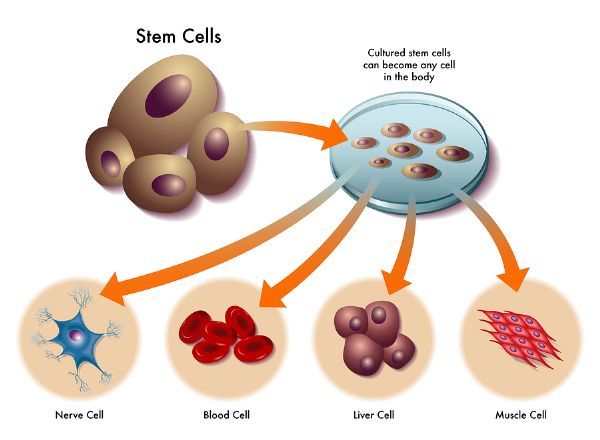
前言干细胞是一类能够无限增殖并保持多向分化潜能的细胞,是形成机体内各组织器官的原始细胞。根据干细胞所处的发育阶段,可分为胚胎干细胞(embryonic stem cell,ESC)和成体干细胞(adult stem cell,ASC)。近年来,在眼科疾病、糖尿病、关节软骨修复及神经退行性疾病等领域,干细胞基础研究和临床试验发展迅速,多款干细胞治疗产品也相继问世。预计在未来20年内,干细胞医疗市场的
前言
干细胞是一类能够无限增殖并保持多向分化潜能的细胞,是形成机体内各组织器官的原始细胞。根据干细胞所处的发育阶段,可分为胚胎干细胞(embryonic stem cell,ESC)和成体干细胞(adult stem cell,ASC)。近年来,在眼科疾病、糖尿病、关节软骨修复及神经退行性疾病等领域,干细胞基础研究和临床试验发展迅速,多款干细胞治疗产品也相继问世。预计在未来20年内,干细胞医疗市场的全球规模将迅速增长,预计干细胞年全球市场规模将于2020年前后达到4000亿美元 [1]。
干细胞治疗现状
由于成体干细胞免疫源性低,在应用时避免了移植排斥反应以及长期使用免疫抑制剂对患 者的伤害。相比于胚胎干细胞和诱导多能干细胞,成体干细胞不易形成畸胎瘤,且不存在伦理问题,因而目前上市的干细胞治疗产品的来源均为成体干细胞。来源于胚胎干细胞的治疗产品均处于临床试验阶段,其适应症集中于眼科疾病。
目前全球范围内已批准多款成体干细胞产品上市,如2011年7月,韩国食品药品管理局批准FCB-Pharmicell公司开发的心脏病治疗药物Hearticellgram-AMI。2015年2月,意大利凯西制药公司的干细胞治疗产品Holoclar获得欧盟委员批准,用于治疗成人中度至重度角膜缘干细胞缺乏症 [2]。
干细胞治疗面临的挑战
从技术上讲,干细胞来源、数量、移植途径等因素使临床应用结果的评估无法完全客观统一,同时成体干细胞体外长期培养可能会导致细胞衰老,产生遗传变异,其分化能力也受年龄限制。从伦理上讲,关于胚胎干细胞的伦理争议从未停止过。
中国与发达国家的差距
以美国为例,其在干细胞研究领域依然保持着全球领先地位,在美国的监管体系中,FDA负责保证干细胞产品的安全性和有效性,生物制品评估与研究中心(CBER)负责干细胞临床试验、生产及销售等环节,可见其监管主体分工明确,责任明确。此外欧盟、日本和韩国也在干细胞临床及产业化方面走在前列。
我国也在干细胞临床监管领域推行了诸多政策,在2015年,国家卫生和计划生育委员会与食品药品监管总局制定了《干细胞临床研究管理办法 (试行)》及相关技术指南,对干细胞制剂及临床研究过程作了详细的规范,同时指出不再按照第三类医疗技术对干细胞治疗产品进行管理 [3]。但是与发达国家相比,我国尚未明确监管机构在干细胞临床试验研究备案受理过程中的具体分工和监管权限,同时干细胞监管文件均无法律层面的强制性要求,且无详细细则。
促进干细胞产业发展的政策建议
•加强干细胞技术管理国际交流合作
应与国际接轨,加强对国外标准、技术法规和政策制定的跟踪研究;
•建立统一质量检验标准
建立规范的质量检验标准有利于提高我国干细胞产业的可信度和安全性;
•明确监管机构具体责任
明确监管机构的具体监管分工,有利于消除监管区空白。
总结
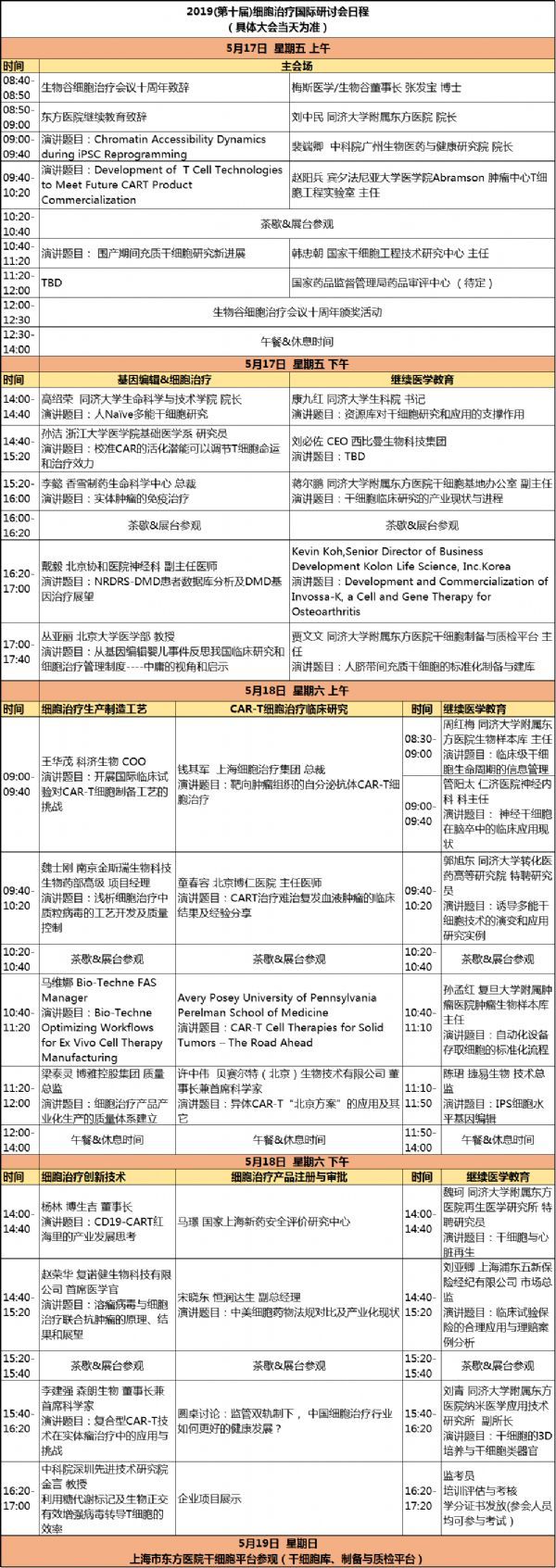
近年来,我国干细胞研究在世界范围内取得了多项突破,我国迄今已有4批35个干细胞临床研究项目经国家卫健委和药监局备案。近期,中国科学院干细胞与再生医学创新研究院启动了干细胞治疗视网膜色素变性、卵巢功能不全及中重度宫腔粘连的3个项目。这些成果均标志着我国正在干细胞治疗领域大步向前,相信随着我国监管体系的日渐成熟、技术领域的不断突破,干细胞治疗的春天不久将会到来。由生物谷和上海市东方医院(同济大学附属东方医院)联合主办的2019(第十届)细胞治疗国际研讨会暨上海市继续医学教育-干细胞库的资源应用与产业化规范将于2019月5月16至19日在上海召开。本次会议以"加快中国细胞治疗产品的上市"为主题,重点聚焦细胞治疗监管政策、实体瘤治疗、细胞治疗临床研究、细胞治疗生产制造工艺,干细胞制备与质控规范、安全与风险管控等主题。参加继续教育考核通过者可授予上海市Ⅰ类继续教育学分10 分。
会议日程:
干细胞是一类能够无限增殖并保持多向分化潜能的细胞,是形成机体内各组织器官的原始细胞。根据干细胞所处的发育阶段,可分为胚胎干细胞(embryonic stem cell,ESC)和成体干细胞(adult stem cell,ASC)。近年来,在眼科疾病、糖尿病、关节软骨修复及神经退行性疾病等领域,干细胞基础研究和临床试验发展迅速,多款干细胞治疗产品也相继问世。预计在未来20年内,干细胞医疗市场的全球规模将迅速增长,预计干细胞年全球市场规模将于2020年前后达到4000亿美元 [1]。
https://www.askdrray.com/prolotherapy-and-stem-cell-therapy/
干细胞治疗现状
由于成体干细胞免疫源性低,在应用时避免了移植排斥反应以及长期使用免疫抑制剂对患 者的伤害。相比于胚胎干细胞和诱导多能干细胞,成体干细胞不易形成畸胎瘤,且不存在伦理问题,因而目前上市的干细胞治疗产品的来源均为成体干细胞。来源于胚胎干细胞的治疗产品均处于临床试验阶段,其适应症集中于眼科疾病。
目前全球范围内已批准多款成体干细胞产品上市,如2011年7月,韩国食品药品管理局批准FCB-Pharmicell公司开发的心脏病治疗药物Hearticellgram-AMI。2015年2月,意大利凯西制药公司的干细胞治疗产品Holoclar获得欧盟委员批准,用于治疗成人中度至重度角膜缘干细胞缺乏症 [2]。
干细胞治疗面临的挑战
从技术上讲,干细胞来源、数量、移植途径等因素使临床应用结果的评估无法完全客观统一,同时成体干细胞体外长期培养可能会导致细胞衰老,产生遗传变异,其分化能力也受年龄限制。从伦理上讲,关于胚胎干细胞的伦理争议从未停止过。
中国与发达国家的差距
以美国为例,其在干细胞研究领域依然保持着全球领先地位,在美国的监管体系中,FDA负责保证干细胞产品的安全性和有效性,生物制品评估与研究中心(CBER)负责干细胞临床试验、生产及销售等环节,可见其监管主体分工明确,责任明确。此外欧盟、日本和韩国也在干细胞临床及产业化方面走在前列。
我国也在干细胞临床监管领域推行了诸多政策,在2015年,国家卫生和计划生育委员会与食品药品监管总局制定了《干细胞临床研究管理办法 (试行)》及相关技术指南,对干细胞制剂及临床研究过程作了详细的规范,同时指出不再按照第三类医疗技术对干细胞治疗产品进行管理 [3]。但是与发达国家相比,我国尚未明确监管机构在干细胞临床试验研究备案受理过程中的具体分工和监管权限,同时干细胞监管文件均无法律层面的强制性要求,且无详细细则。
促进干细胞产业发展的政策建议
•加强干细胞技术管理国际交流合作
应与国际接轨,加强对国外标准、技术法规和政策制定的跟踪研究;
•建立统一质量检验标准
建立规范的质量检验标准有利于提高我国干细胞产业的可信度和安全性;
•明确监管机构具体责任
明确监管机构的具体监管分工,有利于消除监管区空白。
总结
近年来,我国干细胞研究在世界范围内取得了多项突破,我国迄今已有4批35个干细胞临床研究项目经国家卫健委和药监局备案。近期,中国科学院干细胞与再生医学创新研究院启动了干细胞治疗视网膜色素变性、卵巢功能不全及中重度宫腔粘连的3个项目。这些成果均标志着我国正在干细胞治疗领域大步向前,相信随着我国监管体系的日渐成熟、技术领域的不断突破,干细胞治疗的春天不久将会到来。由生物谷和上海市东方医院(同济大学附属东方医院)联合主办的2019(第十届)细胞治疗国际研讨会暨上海市继续医学教育-干细胞库的资源应用与产业化规范将于2019月5月16至19日在上海召开。本次会议以"加快中国细胞治疗产品的上市"为主题,重点聚焦细胞治疗监管政策、实体瘤治疗、细胞治疗临床研究、细胞治疗生产制造工艺,干细胞制备与质控规范、安全与风险管控等主题。参加继续教育考核通过者可授予上海市Ⅰ类继续教育学分10 分。
会议日程:
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->