多篇重要研究成果解读科学家们在抗体疗法研究上取得的新进展!
来源:生物谷原创 2024-02-28 18:00
科学家有望开发出治疗HER2阳性乳腺癌的新型单克隆抗体、科学家开发出一种治疗人类胰腺癌的新型单克隆抗体疗法、单克隆抗体frexalimab在治疗人类复发性多发性硬化症上或能产生有利治疗效果
本文中,小编整理了多篇重要研究成果,共同解读科学家们在治疗人类多种疾病的抗体疗法研究上取得的新进展!
【1】IJMS:科学家有望开发出治疗HER2阳性乳腺癌的新型单克隆抗体
doi:10.3390/ijms25031941
基于单克隆抗体和/或基于细胞的免疫疗法能为癌症治疗提供创新性手段,然而,靶向作用表达反应性抗原的正常细胞的安全性问题依旧存在。因此,科学家们就需要开发出能识别癌症特异性抗原的癌症特异性单克隆抗体,从而减少患者机体不良反应的出现。近日,一篇发表在国际杂志International Journal of Molecular Sciences上题为“A Cancer-Specific Monoclonal Antibody against HER2 Exerts Antitumor Activities in Human Breast Cancer Xenograft Models”的研究报告中,来自日本东北大学医学院等机构的科学家们通过研究开发出了一种新型单克隆抗体,其或能特异性地靶向作用特定类型的乳腺癌细胞,相关研究结果有望为治疗人类HER2阳性的乳腺癌提供一种新型疗法。
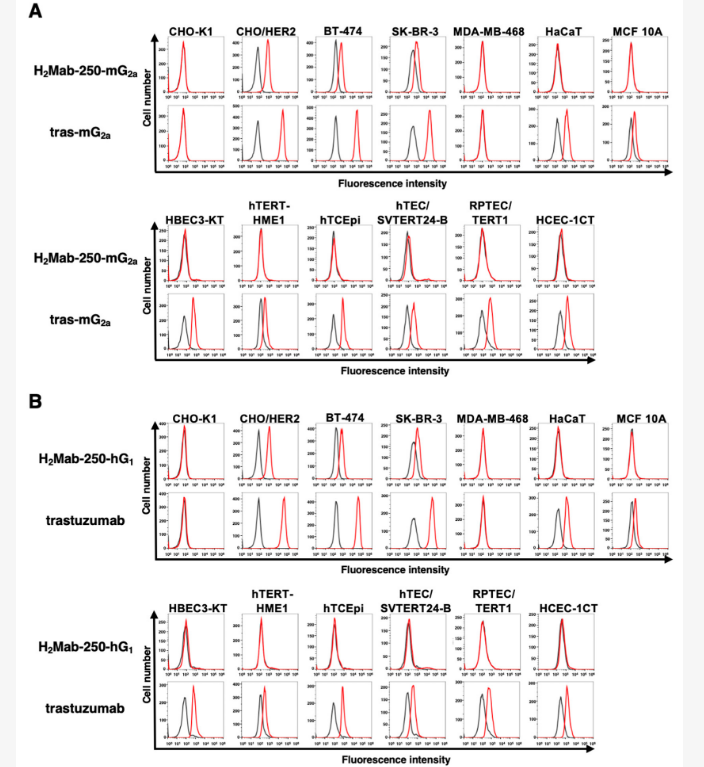
科学家有望开发出治疗HER2阳性乳腺癌的新型单克隆抗体
图片来源:International Journal of Molecular Sciences (2024). DOI:10.3390/ijms25031941
如今,乳腺癌依然是人类面临的全球健康问题,其每年影响着数百万女性的健康,HER2阳性的乳腺癌亚型就是最具侵袭性和挑战性的一种乳腺癌类型,大约20%的乳腺癌病例被归类为HER2阳性的乳腺癌,意味着目前研究人员迫切需要开发出能靶向作用这种特殊乳腺癌亚型的新型疗法。这项研究中,研究人员通过研究开发了一种能精准靶向作用HER2阳性乳腺癌细胞的单克隆抗体,单克隆抗体是一种特殊的蛋白质,其能被工程化改造用来以特殊精确度识别并结合特定的靶点。
HER2阳性的乳腺癌细胞要比健康细胞表面含有更多的HER2蛋白,这种蛋白在细胞生长和分裂过程中扮演着重要角色,而且过量的HER2是HER2阳性肿瘤具有侵袭性背后的原因之一。通过特异性地靶向作用HER2阳性细胞,抗体就能破坏癌细胞的生长和增殖,同时还能减少对周围健康组织的损伤。
【2】Sci Rep:科学家开发出一种治疗人类胰腺癌的新型单克隆抗体疗法
doi:10.1038/s41598-023-44211-6
SIWA318H是一种新型的单克隆抗体,其能选择性地靶向作用表现出有氧糖酵解和氧化性压力的受损或功能异常细胞中所发现的晚期糖基化终产物生物标志物;携带这些生物标志物的细胞往往会功能异常,且与衰老、癌症和其它疾病过程相关的压力或损伤直接相关。近日,一篇发表在国际杂志Scientific Reports上题为“Advanced glycation end product (AGE) targeting antibody SIWA318H is efficacious in preclinical models for pancreatic cancer”的研究报告中,来自美国希望之城国家医疗中心等机构的科学家们通过进行一项临床前研究强调了SIWA318H在抵御人类胰腺癌上的潜力,其是一种晚期糖基化终产物(AGE,advanced glycation end)靶向性抗体。
胰腺癌,尤其是胰腺导管腺癌(PDAC)长期以来一直因为具有侵袭性且对当前疗法选择耐受而闻名,SIWA318H能选择性地靶向作用衰老细胞,或有望作为一种治疗人类胰腺癌的新型疗法。肿瘤微环境中的衰老细胞已经被确定能作为肿瘤发生、生长和对疗法耐受的主要促进因素,SIWA318H是一种专门用来靶向作用AGE而设计的抗体,其能提供一种新方法来消除衰老细胞并重塑机体的肿瘤微环境。
研究者Lewis S. Gruber说道,这些临床前研究结果表明,SIWA318H或许能作为抵御胰腺癌的新型有希望的疗法,通过重塑肿瘤微环境,我们的目标就是改善癌症疗法的治疗效率并潜在给予患者带来更好的治疗结局。这些研究发现揭示了SIWA318H或许具有超凡的能力,其能特异性地将自身吸附到与机体衰老和癌症进展相关的可修饰蛋白上,同时其还能靶向作用衰老细胞,无论是在生物体内还是体外,这些衰老细胞都与人类机体的健康问题相关,这种靶向作用衰老细胞的能力是药物如何发挥作用的重要部分,此外,SIWA318H还能诱发一种称之为抗体依赖性细胞介导的细胞毒性(ADCC,antibody-dependent cell-mediated cytotoxicity)的过程,从而就能帮助免疫细胞有效清除癌细胞。
【3】NEJM:单克隆抗体frexalimab在治疗人类复发性多发性硬化症上或能产生有利治疗效果
doi:10.1056/NEJMoa2309439
近日,一篇发表在国际杂志New England Journal of Medicine上题为“Inhibition of CD40L with Frexalimab in Multiple Sclerosis”的研究报告中,来自法国里尔大学等机构的科学家们通过研究发现,对于复发性多发性硬化症患者而言,抗CD40L单克隆抗体frexalimab对于新型钆(gadolinium)增强T1加权病变的数量或能产生有利的影响。
这项研究中,研究者Patrick Vermersch等人进行了一项II期双盲试验来分析frexalimab疗法在治疗人类复发性多发性硬化症上的疗效。患者被分配每四周静脉注射1200mg剂量的frexalimab,每两周皮下注射300mg的frexalimab,或者每一种积极性治疗以4:4:1:1的比例匹配安慰剂,共有125名患者完成了为期12周的双盲试验。
研究人员发现,在接受1200mg和300mg剂量frexalimab的研究组中,新发钆增强T1加权病变的调整平均数量分别为0.2和0.3,而联合安慰剂组研究对象则为1.4。相比安慰剂组而言,1200mg和300mg剂量frexalimab的研究组的比率分别为0.11和0.21,对于二次成像终点而言,结果通常与初次分析的结果方向相同,患者表现出的COVID-19和头痛是最常见的不良事件。
【4】Nat Biomed Eng:一种可切换的双特异性抗体或有望作为人类新型癌症疗法
doi:10.1038/s41551-023-01147-6
在不断发展的抗癌斗争中,免疫疗法展现出了一个折点,其能利用宿主机体的免疫系统来抵御癌症,这一概念在一个多世纪以前都有了,但直到最近几年才取得了长足的发展。这种转变的先驱就是诸如CAR-T细胞疗法等疗法,其能重编程患者机体的T细胞来攻击癌细胞,在这一领域,双特异性T细胞衔接器或双特异性抗体已经在临床中称为有效治疗很多血源性癌症的疗法,而且目前正在实体瘤疗法中进行评估。这些抗体能同时抓住癌细胞和T细胞,从而在其二者之间建立连接,这种连接/接近或能诱发T细胞释放武器从而杀灭癌细胞。然而,双特异性T细胞衔接器就好像很多癌症疗法一样,其也面临着很多障碍,比如细胞特异性靶向作用的限制,即靶外肿瘤毒性,这就意味着,肿瘤能被正确靶向作用但体内其它的健康细胞也会被作用,从而就会导致健康组织发生损伤。此外,双特异性抗体还会导致免疫系统过度激活,而这或许就是细胞因子释放综合征(CRS,cytokine release syndrome)和神经毒性的前兆。
近日,一篇发表在国际杂志Nature Biomedical Engineering上题为“Small-molecule-mediated control of the anti-tumour activity and off-tumour toxicity of a supramolecular bispecific T cell engager”的研究报告中,来自宾夕法尼亚大学等机构的科学家们通过研究发现了一种新方法,其或能通过开发一种配备了“关闭开关”(off switch)的双特异性T细胞纳米衔接器来回避很多有害影响。
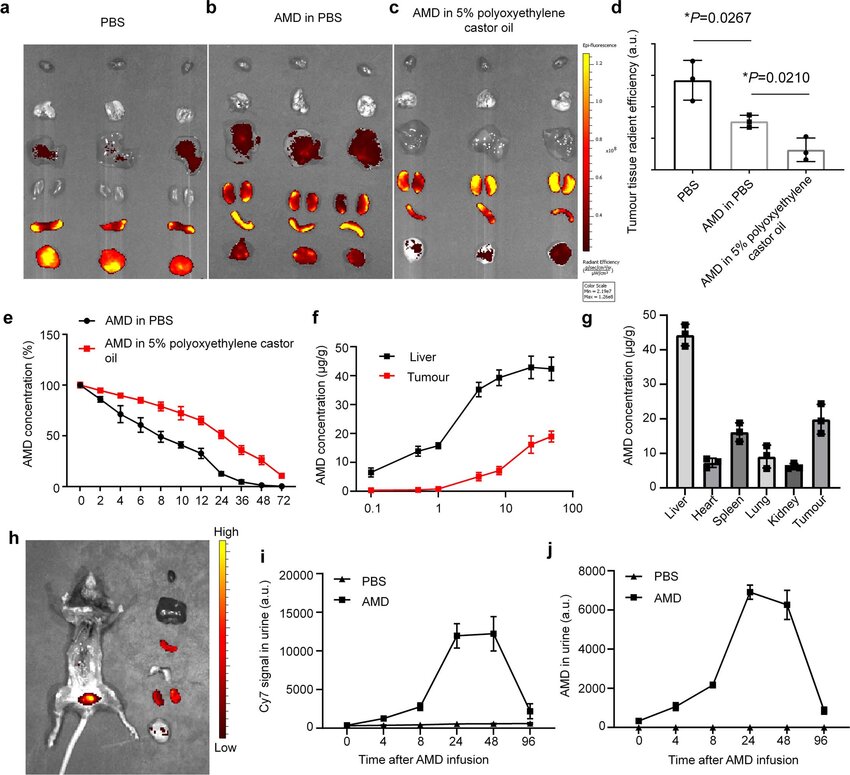
一种可切换的双特异性抗体或有望作为人类新型癌症疗法
图片来源:Nature Biomedical Engineering (2024). DOI:10.1038/s41551-023-01147-6
研究者Mitchell说道,我们非常激动地发现,双特异性抗体能通过特殊的方式被调节从而促使我们利用其强大的抗癌潜能,且不会诱导对健康组织的毒性效应。这种新型可控的药物运输机制(研究者称其为可切换的双特异性T细胞纳米衔接器,SiTEs)能通过给予FDA批准的小分子药物金刚烷胺(amantadine)将这种可切换的组分添加到抗体中。
【5】PLoS Biol:科学家有望开发出能抵御多种流感病毒形式的新型抗体
doi:10.1371/journal.pbio.3002415
抑制流感病毒血凝素(HA)预期受体结合的抗体滴度被公认与保护机体抵御感染直接相关。近日,一篇发表在国际杂志PLoS Biology上题为“A new class of antibodies that overcomes a steric barrier to cross-group neutralization of influenza viruses”的研究报告中,来自匹兹堡大学等机构的科学家们通过研究识别出了一种此前未被识别的特殊抗体(能保护机体抵御疾病的免疫系统蛋白),其似乎能帮助中和多种形式的流感病毒;相关研究发现或能帮助开发更广泛的保护性流感疫苗。
流感疫苗能促使机体免疫系统制造抗体来结合入侵的流感病毒表面称之为血凝素的病毒性蛋白,从而阻断其进入宿主机体细胞中;不同的抗体能以不同的方式结合血凝素的不同部位,而血凝素本身也会随着时间推移而进化,从而导致逃避老的抗体的新型流感病毒毒株的出现,新的流感疫苗每年都是基于对最主要的病毒毒株的预测而推出的。目前科学家们广泛的研究正在为开发新型流感疫苗从而更好地保护机体一次性抵御多种病毒毒株铺平了道路,许多科学家重点关注了能同时保护机体抵御H1型和H3型的抗体,这两种病毒有多种能诱发广泛感染的病毒毒株。
这项研究中,研究者Simmons及其同事将目光锁定到了一些微小改变上,即在一些H1型流感病毒毒株中,在组成血凝素的基本元件的序列上所存在的一些小的改变,某些能中和H3型病毒的抗体同时也能中和H1型,但如果其血凝素发生改变的话,即133a插入,则不会被抗体所中和。如今,通过对来自患者血液样本进行一系列实验,研究人员识别出了一类特殊的抗体能中和特定的H3型毒株和H1型毒株,无论是否其发生了133a的插入;独特的分子特征就能促使这些抗体与能通过其它方式来交叉中和H1和H3型的抗体区分开来。
【6】Cell Rep Med:揭示特殊抗体保护机体抵御HIV感染背后的分子机制
doi:10.1016/j.xcrm.2023.101201
靶向作用HIV-1 Env的中和性抗体如今已经被证明能保护 机体抵御全身性感染。近日,一篇发表在国际杂志Cell Reports Medicine上题为“HIV-1 neutralizing antibodies provide sterilizing immunity by blocking infection of the first cells”的研究报告中,来自德国波鸿大学等机构的科学家们通过研究发现,HIV抗体或能通过抑制第一个细胞的感染来提供消除性免疫作用(sterilizing immunity)。
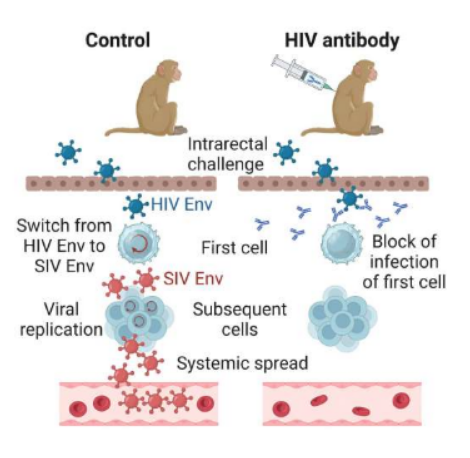
揭示特殊抗体保护机体抵御HIV感染背后的分子机制
图片来源:Cell Reports Medicine (2023). DOI:10.1016/j.xcrm.2023.101201
研究者Klaus Uberla博士说道,HIV是一种能通过体液传播的病毒,在大多数情况下,其能通过生殖道或直肠的粘膜,并在HIV包膜蛋白的帮助下穿过位于粘膜的免疫系统中的单一细胞,并在这里开始从而促使病毒扩散到整个机体,且会削弱宿主机体的免疫系统。自1981年科学家们首次发现HIV感染以来,该病毒就开始在人群中快速扩散起来了,据联合国艾滋病规划署的数据显示,截至2022年,全球大约有3900万人感染了HIV,目前针对HIV尚无有效的治愈性手段,而且疫苗也并未开发出来,但科学家们在不断研究来开发新型HIV感染的疗法。
20多年以来,我们已经知道了保护机体抵御HIV感染的特殊抗体,其能促使很多HIV病毒变种变得无害,这也就意味着,其能产生一种广泛的中和性效应,但目前研究人员并不清楚这个过程到底是如何发挥作用的,也并不知道抗体会在什么时候阻断病毒在整个宿主机体的传播扩散。当前的研究计划或许就给出了答案,如今研究人员通过联合研究阐明了,HIV抗体能抑制第一批细胞的感染,而且粘膜中抗体的浓度足以能够实现这一目的。
【7】PNAS:利用特殊抗体来阻断组蛋白功能或能减缓机体的肺部纤维化
doi:10.1073/pnas.2215421120
肺部纤维化(lung fibrosis)是一种让人衰弱的疾病,仅在美国就影响着近25万人的健康,且每年都有5万例新发病例,目前针对肺纤维化并没有有效的疗法,而且可用的治疗性手段也非常有限,这或许就迫使研究人员需要更好地理解患者为何会患病,以及开发新型靶向性疗法。近日,一篇发表在国际杂志Proceedings of the National Academy of Sciences上题为“Externalized histones fuel pulmonary fibrosis via a platelet-macrophage circuit of TGFβ1 and IL-27”的研究报告中,来自波士顿大学等机构的科学家们识别出了促进肺部纤维化的不同细胞类型之间的异常相互作用,尤其是血小板和肺部免疫细胞等。
据研究者介绍,这项研究强调了在肺部纤维化中不同的细胞类型之间是如何相互协作的,血小板是在正常情况下会形成血凝块的细胞,但在肺部纤维化中,其会参与免疫细胞的功能,最终攻击健康细胞并损伤肺部功能,虽然免疫系统应该保护机体抵御病毒和细菌,但在肺部纤维化患者中其却会损伤机体自身健康。
这项研究中,研究人员发现,名为中性粒细胞的免疫细胞所释放的称之为组蛋白的染色体结构支持蛋白,或能通过激活来自血小板的免疫介导子—转化生长因子β1(TGFβ1)的产生来开启异常的相互作用,随后TGFβ1就会阻断来自巨噬细胞中的另外一种介导子的释放,即白介素-27(IL-27),这种抑制作用或许就会阻止IL-27抑制肺部纤维化。研究者Arjun Sharma解释道,尽管此前认为组蛋白会参与到纤维化过程中,但其是如何介导疾病的发生,目前研究人员并不完全清除,本文研究或许就为揭示不同细胞类型之间相互作用的改变如何促进组蛋白介导的纤维化发育提供了新的见解。
【8】Nature:科学家有望通过抗原表位编辑技术来改善CAR-T细胞和单克隆抗体疗法的疗效
doi:10.1038/s41586-023-06496-5
尽管过继性免疫疗法(adoptive immunotherapies)在针对一种不必要的谱系抗原(比如B细胞急性淋巴细胞白血病中的CD19)时观察到了相当大的疗效,但由于缺乏肿瘤限制性的抗原,这种疗法的广泛适用性受到了一定的阻碍;急性髓性白血病免疫疗法能靶向作用造血干细胞/祖细胞(HSPCs)或分化的髓细胞中所表达的基因,从而就会导致患者出现难以忍受的靶向或脱靶肿瘤毒性作用。
近日,一篇发表在国际杂志Nature上题为“Epitope editing enables targeted immunotherapy of acute myeloid leukaemia”的研究报告中,来自Dana-Farber癌症研究所等机构的科学家们通过研究向供体造血干/祖细胞(HSPCs)这能够引入了一种遗传改变,从而使其能在急性髓性白血病(AML)的免疫疗法中存活下来。
当宿主机体的免疫系统遭遇外来抗原(病原体或肿瘤的一部分)时,其就会试图识别并对其中和,抗原表位(epitopes)是这些抗原的一部分,免疫系统能看到抗原表位并将其视为引起机体免疫反应的特殊靶点。尽管嵌合抗原受体(CAR)T细胞和单克隆抗体在通过靶向作用“流氓细胞”的抗原在治疗恶性血液肿瘤上展现出了巨大希望,但由于缺乏肿瘤特异性标志物,其在AML中的应用一直受到了阻碍,这或许就会导致在治疗期间出现损伤宿主机体健康细胞和组织的风险。
【9】Nat Commun:科学家有望开发出一种治疗人类癌症的新型抗体疗法
doi:10.1038/s41467-023-39679-9
所有被批准用于癌症疗法的抗体都是单克隆IgGs,但在临床前数据的比较支持下,IgE的生物学特性提供了增强效应细胞效力的潜力。近日,一篇发表在国际杂志Nature Communications上题为“Safety and anti-tumour activity of the IgE antibody MOv18 in patients with advanced solid tumours expressing folate receptor-alpha: a phase I trial”的研究报告中,来自盖伊和圣托马斯医院等机构的科学家们通过研究对一种新型的癌症免疫疗法进行首次临床试验发现,其或许能展现出非常有希望的研究结果,或能让那些对当前癌症疗法没有反应的患者获益。

科学家有望开发出一种治疗人类癌症的新型抗体疗法
图片来源:Nature Communications (2023). DOI:10.1038/s41467-023-39679-9
文章中,研究人员分析了是否名为IgE的抗体能用来治疗人类癌症;免疫疗法是通过刺激机体自身的天然防御系统来攻击癌症从而发挥作用,目前在癌症中所使用的所有抗体药物都属于一种名为IgG的抗体类型,但IgE抗体此前并未在人类中进行过测试,IgG抗体主要参与攻击机体中的细菌和病毒,但IgE抗体则会进化地针对诸如蠕虫和吸虫等寄生虫。
I期临床试验结果表明,药物MOv18 IgE或能促使对常规疗法并没有反应的卵巢癌患者机体的肿瘤发生萎缩,更重要的是,相关研究结果还表明,基于MOv18 IgE的疗法对于几乎所有患者的耐受性都较好。研究者James Spicer教授说道,IgE是一种全新形式的抗体疗法,其在I期临床试验中展现出了巨大的希望,而本文研究结果表明,这种药物在患者机体中的耐受性良好,且能缩小卵巢癌患者机体中的癌变肿瘤。
【10】Sci Transl Med:新型抗体疗法或能在临床前模型中预防肠道移植物抗宿主病的发生
doi:10.1126/scitranslmed.add1175
Notch信号通路能促进小鼠同种异体造血干细胞移植(allo-HCT)后机体的T细胞致病性和移植物抗宿主疾病(GVHD,graft-versus-host disease)的发生,其中Delta样Notch配体DLL4发挥着主导角色。近日,一篇发表在国际杂志Science Translational Medicine上题为“Notch signaling drives intestinal graft-versus-host disease in mice and non-human primates”的研究报告中,来自麻省总医院等机构的科学家们通过进行一项临床前试验表明,一种实验性的抗体疗法在很大程度上能防止肠道中被称为移植物抗宿主疾病的骨髓转移并发症的发生,而不会引起机体广泛的免疫抑制反应。
即使骨髓移植治愈了白血病或淋巴瘤,但GVHD(供体移植物中的T细胞会攻击受体自身的组织)仍然可能是致命性的,这种情况是骨髓移植相关的死亡和长期不良健康后果的主要原因之一。长期以来,研究人员一直在寻找预防这种致死性并发症的方法,本文研究或能为科学家们进行人类临床试验来寻求新型疗法铺平道路。Maillard教授说道,我们发现,只需要在一直前立即给予单一剂量的抗体来阻断Notch信号通路就能预防胃肠道GVHD的发生,而且还不会损伤机体其它部位的免疫功能,时间至关重要,在任何GVHD症状出现之前进行干预就能使得长期保护成为可能。
此前研究中,研究人员发现,供体免疫细胞GVHD引起的活性(尤其是T细胞)需要一种名为Notch通路的信号通路。在对GVHD小鼠模型进行的实验中,研究人员发现,在移植的前几天内,阻断特定的Notch激活子(名为DLL4)或能有效预防GVHD的发生,其能阻断供体T细胞浸润并攻击肠道(严重GVHD的主要部位),但并不会阻断T细胞的感染和其所具有的抗癌能力。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


