2021年10月Cell期刊不得不看的亮点研究
来源:本站原创 2021-10-31 23:57
2021年10月31日讯/生物谷BIOON/---2021年10月份即将结束了,10月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2021年10月31日讯/生物谷BIOON/---2021年10月份即将结束了,10月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:新研究揭示垃圾DNA在哺乳动物发育中起着至关重要的作用
doi:10.1016/j.cell.2021.09.021
我们近一半的DNA已经被视为垃圾,是进化的弃物:边缘化或破损的基因,整入在我们基因组中被肢解或沉默的病毒,它们都与人类机体或人类进化无关。但是过去十年的研究已表明,这些DNA “暗物质”(即垃圾DNA)中的一些确实有其功能,主要是调节编码蛋白的宿主基因---仅占我们总基因组的2%---的表达。然而,生物学家们仍在争论,这些垃圾DNA的调控序列是否在身体中发挥重要或有害的作用,还是仅仅是偶然的,是有机体不需要也能生存的意外。
在一项新的研究中,来自美国加州大学伯克利分校和华盛顿大学的研究人员探索了这种垃圾DNA的一个组成部分--转座子---的功能,其中转座子是能够入侵其宿主基因组的自私DNA序列。该研究显示,至少有一个转座子家族--一种入侵我们基因组的古老病毒,在小鼠的生存能力中起着关键作用,也许在所有哺乳动物中也是如此。当他们在小鼠中敲除一个特定的转座子时,一半的小鼠幼崽在出生前就死亡了。这是第一个表明 “垃圾DNA”对哺乳动物生存至关重要的例子。相关研究结果发表在2021年10月28日的Cell期刊上,论文标题为“A mouse-specific retrotransposon drives a conserved Cdk2ap1 isoform essential for development”。
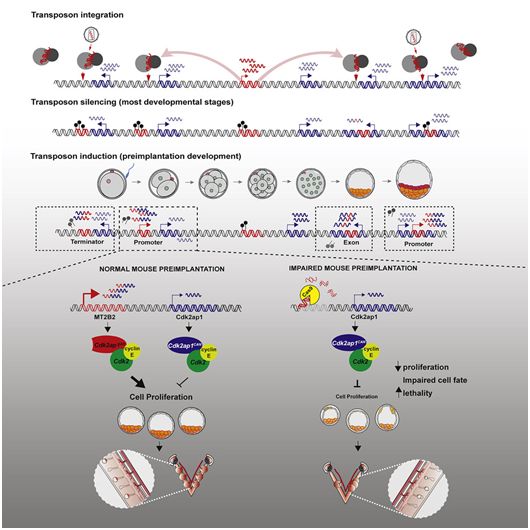
图片来自Cell, 2021, doi:10.1016/j.cell.2021.09.021。
根据论文共同通讯作者、加州大学伯克利分校分子与细胞生物学教授Lin He的说法,这些发现突出了一种经常被忽视的进化驱动因素:病毒整合到我们的基因组中并被重新用作宿主基因的调节者,开启了以前没有的进化选择。
2.Cell:新工具Repair-seq可用于改进CRISPR基因编辑
doi:10.1016/j.cell.2021.10.002
通过改变活细胞内的DNA序列来编辑基因组的能力对于研究来说是非常强大的,并为疾病的治疗带来了巨大的希望。然而,现有的基因组编辑技术经常导致不必要的突变,或者根本无法引入任何变化。这些问题使该领域无法发挥它的全部潜力。
如今,在第一项新的研究中,美国普林斯顿大学研究员Britt Adamson、麻省理工学院生物系教授Jonathan Weissman、之前在Editas Medicine公司工作的Cecilia Cotta-Ramusino及其同事们详细介绍了一种名为Repair-seq的新方法,它详细地揭示了基因组编辑工具如何发挥作用。相关研究结果发表在2021年10月28日的Cell期刊上,论文标题为“Mapping the genetic landscape of DNA double-strand break repair”。
为了修复DNA,细胞使用了许多不同的机制,每种机制都涉及到一系列在不同途径中协同工作的基因。Repair-seq允许人们通过同时分析数百个基因如何影响在受损部位产生的突变,来探测这些途径对修复特定DNA损伤的贡献。这些作者随后可以构建DNA修复的机制模型,并了解这些机制如何影响基因组编辑。Adamson及其同事们将他们的方法应用于最常用的基因组编辑方法之一,即CRISPR-Cas9,后者采用细菌Cas9核酸酶切过双链DNA分子的两条链,从而产生称为双链断裂的DNA损伤。
Repair-seq实验产生了大量的数据。由Hussmann领导的对这些数据的分析,产生了不同的DNA修复途径如何与特定类型的Cas9诱导突变相关联的图谱。在该领域丰富的研究历史基础上,Hussmann的分析阐明了已经知道的途径,并确定了新的途径,这些途径共同突出了参与双链断裂修复的巨大复杂性和一系列系统。这项研究中分析的一组深层数据如今被发布在一个在线门户网站(https://seq.repair/)上,其他人可以用这些数据来探究DNA修复基因和途径。
3.Cell:揭示强大的新技术允许研究蛋白在细胞内如何改变形状
doi:10.1016/j.cell.2021.09.026
了解蛋白在细胞中工作时是如何弯曲、扭曲和改变形状的,对于理解正常的生物学和疾病有极大的重要性。但是,由于缺乏良好的蛋白工作成像方法,对蛋白动力学的深入理解通常是难以捉摸的。如今,在一项新的研究中,来自美国北卡罗来纳大学教堂山分校的研究人员首次发明了一种方法,可以使这一领域向前迈出一大步。相关研究结果发表在2021年10月28日的Cell期刊上,论文标题为“Biosensors based on peptide exposure show single molecule conformations in live cells”。
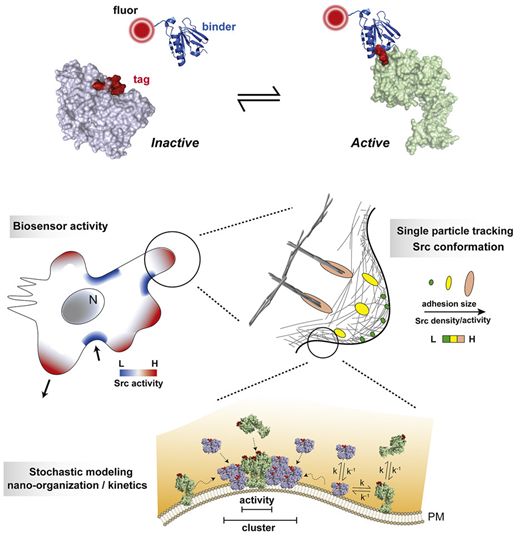
图片来自Cell, 2021, doi:10.1016/j.cell.2021.09.026。
论文共同通讯作者、北卡罗来纳大学教堂山分校医学院药理学教授Klaus Hahn博士说,“在此之前没有人能够开发出一种方法,能够以如此普遍的方式,完成这种方法所做的工作。因此,我认为它可能会产生非常大的影响。”
4.Cell:发现在骨关节炎患者中起作用的基因
doi:10.1016/j.cell.2021.07.038
骨关节炎是全世界疼痛和残疾的主要原因。针对骨关节炎,没有治疗方法,只有缓解疼痛。患者的关节会发炎,早上起来感觉吱吱作响,身体僵硬。有些患者使用止痛药和锻炼作为治疗手段。其他人则不得不求助于外科手术和假肢。目前全世界大约有3亿人患有骨关节炎。
在一项新的研究中,来自欧洲和亚洲的一个国际研究团队结束了在整个世界进行的最大规模的调查。他们检查了80多万人的样本。绝大多数人来自欧洲,但也有不少人来自亚洲。被调查者中只有不到20万人患有骨关节炎。来自9个不同国家的155名研究人员合作进行了这项研究。他们的研究结果产生了许多答案。相关研究结果近期发表在Cell期刊上,论文标题为“Deciphering osteoarthritis genetics across 826,690 individuals from 9 populations”。
论文共同作者、挪威科技大学遗传流行病学中心研究员Anne Heidi Skogholt说,“我们发现了哪些基因与骨关节炎患者有关。这反过来可以用来开发能够在早期阶段减缓这种疾病的药物。”这些作者还发现女性和膝关节等负重关节存在特殊的骨关节炎风险因素。
5.Cell:肠道病原体诱导组织耐受性,防止肠道神经元在后续感染时死亡
doi:10.1016/j.cell.2021.10.004
简单的胃肠道感染可能造成很大的损害。有1亿个神经元散布在胃肠道上,可能被肠道感染所消灭,从而潜在导致长期的胃肠道疾病。但是肠道感染可能有一个好处。一项新的研究发现肠道感染了细菌或寄生虫的小鼠产生了一种独特的耐受性,与教科书上的免疫反应完全不同。该研究描述了肠道巨噬细胞如何通过保护肠道神经元来应对先前的肠道病原体攻击,防止它们在未来的病原体袭击时死亡。这些发现最终可能对与肠道神经元的失控死亡有关的疾病(比如肠易激综合征)产生临床影响。相关研究结果于2021年10月29日在线发表在Cell期刊上,论文标题为“Enteric pathogens induce tissue tolerance and prevent neuronal loss from subsequent infections”。
论文共同通讯作者兼论文第一作者、洛克菲勒大学博士后研究员Tomasz Ahrends和Mucida实验室的其他成员首先用一种非致命的沙门氏菌菌株感染了小鼠,其中沙门氏菌是一种标准的食物中毒的细菌来源。
小鼠在大约一周的时间内清除了这种细菌感染,在此过程中失去了一些肠道神经元。然后他们用另一种类似的食源性细菌感染这些相同的小鼠。这一次,小鼠的肠道神经元没有进一步丧失,这表明第一次感染形成了一种防止了神经元丧失的耐受性机制。
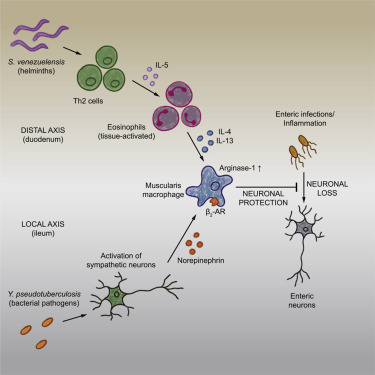
图片来自Cell (2021). DOI: 10.1016/j.cell.2021.10.004。
Mucida发现,在原发性细菌感染期间,肠道神经元会召唤肠道巨噬细胞,后者会赶到受感染区域,保护这些脆弱的肠道神经元免受未来的攻击。然而,当蠕虫侵入肠道时,是T细胞招募了肠道巨噬细胞,将它们送到甚至是肠道的远处,以确保全部肠道神经元免受未来的伤害。最后,通过不同的途径,细菌和蠕虫感染都导致了对肠道神经元的保护。
6.Cell:新研究揭示身体某些部位为何对触摸如此敏感
doi:10.1016/j.cell.2021.09.023
身体的某些部位---例如手和嘴唇---比其他部位更敏感,使它们成为我们辨别周围世界最复杂细节能力的重要工具。这种能力是我们生存的关键,使我们能够安全地在周围环境中航行,迅速了解和应对新的情况。也许毫不奇怪的是,大脑为这些敏感的皮肤表面提供了相当大的表征空间,这些皮肤表面专门用于精细的、有识别力的触摸,并通过支配它们的感觉神经元不断收集详细信息。但是,感觉神经元和大脑之间的联系如何导致如此极其敏感的皮肤呢?
在一项新的研究中,来自美国哈佛医学院的研究人员以小鼠为研究对象,揭示了一种新的机制,它可能是某些皮肤区域更敏感的基础。相关研究结果于2021年10月11日在线发表在Cell期刊上,论文标题为“Mechanoreceptor synapses in the brainstem shape the central representation of touch”。
这些作者发现在小鼠大脑中敏感皮肤表面的过度表征(overrepresentation)是在青春期早期形成的,可以精确定位到脑干。此外,定居于皮肤较敏感部位并向脑干传递信息的感觉神经元比身体较不敏感部位中的神经元形成更多的连接和更强的连接。
论文通讯作者、哈佛医学院神经生物学教授David Ginty说,“这项研究针对为何更多的大脑表征空间用于具有高触摸敏锐度的皮肤表面提供了机制上的理解。基本上,这是一种有助于解释为何一个人在身体需要更强的感觉敏锐度的部位有这种感觉敏锐度的机制。”
7.Cell:被发现近70年终于派上用场!来自土壤中的化合物潮霉素A或能有效治疗慢性莱姆病!
doi:10.1016/j.cell.2021.09.011
多年来,慢性莱姆病(Lyme disease)让临床医生和患者都感到非常沮丧,其所带来的严重的疾病症状包括慢性疲劳、肌肉和关节疼痛、关节炎或认知困难等,这种疾病会严重扰乱患者的生活,而且目前尚无有效的治疗方法。那么到底是否有一种方法能防止急性莱姆病进展为慢性莱姆病呢?近日,一篇发表在国际杂志Cell上题为“A selective antibiotic for Lyme disease”的研究报告中,来自美国东北大学等机构的科学家们通过研究发现了一种治疗急性莱姆病的靶向性疗法。
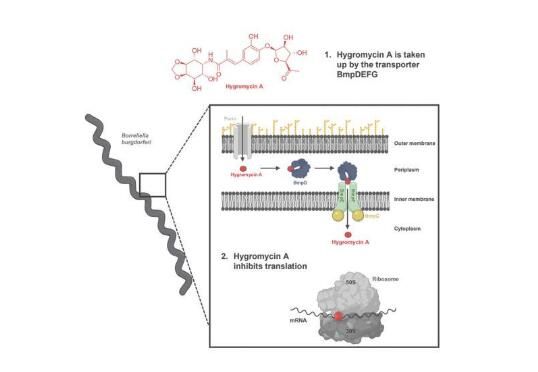
图片来源:DOI:10.1016/j.cell.2021.09.011。
此前研究中,研究人员发现,有长期莱姆病症状的患者往往趋向于拥有一种不同于健康人群机体的肠道微生物组;因此,研究者认为,诸如多西环素或阿莫西林等广谱抗生素或许为慢性莱姆病或“疗法后莱姆病”的发生奠定了坚实的基础。于是研究人员开始寻找一种能靶向作用伯氏疏螺旋体的化合物,最终他们发现了一种特定的化合物—潮霉素A(Hygromycin A),其是土壤中存在的一种抗菌化合物,最早于1953年被科学家们发现,当时科学家们认为该化合物并没有任何效用。
8.Cell:在猴子、老鼠身上发现的RetroCHMP3基因有望作为一种新型抗病毒药物来阻断HIV、埃博拉和其他人类致命病毒
doi:10.1016/j.cell.2021.09.008
在一项新的研究中,来自美国犹他大学、洛克菲勒大学和宾夕法尼亚州立大学的研究人员确定了在小鼠和猴子身上发现的CHMP3基因变体(即RetroCHMP3)如何干扰HIV病毒和埃博拉病毒等有包膜病毒复制。这种变体导致CHMP3基因编码的蛋白发生改变,破坏了有包膜病毒离开受感染细胞的能力,并阻止它们继续感染其他细胞。这一发现最终可能导致人们开发出新的医学干预措施来自阻止有包膜病毒感染。相关研究结果于2021年9月30日在线发表在Cell期刊上,论文标题为“RetroCHMP3 blocks budding of enveloped viruses without blocking cytokinesis”。
通常情况下,一些病毒将自己包裹在细胞膜中,然后通过从宿主细胞中出芽来实现退出。RetroCHMP3基因将这一过程延迟了足够长的时间,以至于病毒无法利用ESCRT途径从宿主细胞中逃出。
论文共同通讯作者、犹他大学医学院人类遗传学系进化遗传学家Nels Elde博士说,“这是一个意想不到的发现。我们感到惊讶的是,只要稍微放慢我们的细胞生物学,就会使病毒复制失去作用。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


