Nature:揭示抗抑郁药氯胺酮靶向人源NMDA受体的分子机制
来源:脑科学与智能技术卓越创新中心 2021-08-01 20:59
《自然》在线发表题为《氯胺酮作用于人源NMDA受体的结构基础》的研究论文,该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、神经科学国家重点实验室、上海脑科学与类脑研究中心研究员竺淑佳研究组与中科院上海药物研究所研究员罗成研究组合作完成。研究通过冷冻电镜解析了NMDA受体结合快速抗抑郁药氯胺酮的三维结构,确定了氯胺酮在NMDA受体上的结合位点
《自然》在线发表题为《氯胺酮作用于人源NMDA受体的结构基础》的研究论文,该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、神经科学国家重点实验室、上海脑科学与类脑研究中心研究员竺淑佳研究组与中科院上海药物研究所研究员罗成研究组合作完成。研究通过冷冻电镜解析了NMDA受体结合快速抗抑郁药氯胺酮的三维结构,确定了氯胺酮在NMDA受体上的结合位点,并进一步通过电生理功能实验和分子动力学模拟,阐明了氯胺酮与NMDA受体结合的分子基础。
传统抗抑郁药多数作用于单胺能神经系统,需要持续用药数周甚至数月后才能起效,并且对三分之一的难治性抑郁症患者没有治疗效果。氯胺酮作为能快速起效的新型抗抑郁药,一剂亚麻醉剂量用药几小时内就能显着改善患者的情绪低落,自我评价低等负面症状,甚至减弱患者自杀意念,尤其对难治性抑郁症有治疗效果。但是,氯胺酮可造成分离性幻觉、成瘾等副作用,限制了其临床应用。因此,研发副作用更小且能快速起效的新型抗抑郁药是未来的研究方向。
已有研究显示,氯胺酮作为大脑内重要的谷氨酸门控离子通道NMDA受体的阻断剂,可通过抑制NMDA受体通道活性,参与突触传递及突触可塑性信号通路的调控,进而恢复慢性压力导致的皮层与海马区域的突触损伤。因此,解析氯胺酮在NMDA受体上的结合位点,并阐明氯胺酮与NMDA受体之间如何相互作用,对基于氯胺酮/NMDA受体复合物结构设计新型抗抑郁药的研究具有重要意义。竺淑佳研究组长期从事NMDA受体结构与功能的系列研究,在NMDA受体家族不同亚型的三维结构、构象动力学、变构调节、药理学和门控开放机制等领域取得系列成果(Nat Struct Mol Biol 2013; PNAS 2014; Cell 2016; Cell Rep 2018; Neuron 2021)。
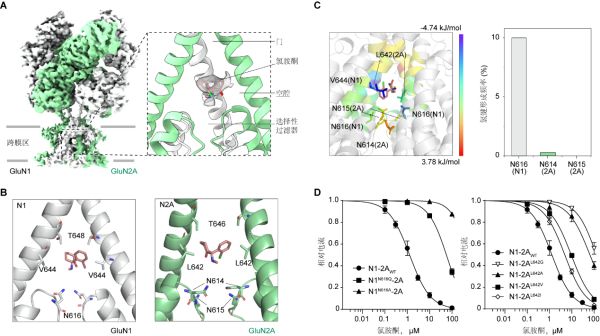
该研究中,科研人员聚焦在成年哺乳动物脑内表达最丰富的两种亚型GluN1-GluN2A和GluN1-GluN2B NMDA受体上,前期利用真核细胞表达系统进行了大量蛋白表达与纯化的条件摸索。在得到稳定的NMDA受体蛋白后,科研人员结合冷冻电镜技术解析了氯胺酮结合的人源GluN1-GluN2A和GluN1-GluN2B亚型NMDA受体的三维结构。在NMDA受体的跨膜区发现了氯胺酮的电子云密度图,进而确认了氯胺酮的结合位点在离子通道的门控与选择性过滤器中间的空腔内。空腔顶部和底部分别由极性氨基酸苏氨酸和天冬酰胺组成,空腔中部由疏水氨基酸颉氨酸和亮氨酸组成。科研人员通过点突变筛选及电生理实验鉴定了GluN1-N616及GluN2A-L642(同源GluN2B-L643)这两个关键氨基酸是参与氯胺酮结合的关键氨基酸。这两个位点的突变会显着影响氯胺酮抑制NMDA受体通道活性的效力,证明这两个关键氨基酸在氯胺酮抑制通道活性过程中发挥重要作用。为进一步解析受体与氯胺酮之间的相互作用,科研人员进行了分子动力学模拟。模拟结果发现,GluN2A-L642对氯胺酮结合能的贡献最大,其疏水侧链可与氯胺酮形成疏水作用,并发现了GluN1-N616会与氯胺酮形成氢键作用。
该研究通过电镜发现并确认了氯胺酮在NMDA受体上的结合位点,揭示GluN1-N616的氢键作用和GluN2A-L642的疏水作用,在氯胺酮稳定结合在NMDA受体的通道空腔内并阻断通道的过程中起关键作用。研究还进一步探讨了手性异构体R-氯胺酮和S-氯胺酮在结合和分子机制上的异同。研究中的系列发现为基于NMDA受体结构设计新型抗抑郁药奠定了基础。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


