针对NRG1融合实体瘤,HER2/3双抗一周内斩获两项突破性疗法认定
来源:医药魔方 2023-07-10 17:49
7月5日, Merus宣布美国FDA已授予公司HER2/3双抗zenocutuzumab(Zeno)突破性治疗认定(BTD),用于治疗此前接受过全身治疗的晚期不可切除或转移性NRG1融合(NRG1+)
7月5日, Merus宣布美国FDA已授予公司HER2/3双抗zenocutuzumab(Zeno)突破性治疗认定(BTD),用于治疗此前接受过全身治疗的晚期不可切除或转移性NRG1融合(NRG1+)非小细胞肺癌(NSCLC)患者。就在前几日(6月30日),FDA授予zenocutuzumab另一项BTD,用于治疗在既往全身治疗进展后或没有令人满意的替代治疗方案的NRG1+胰腺癌患者。

去年11月,Merus表示会见了美国FDA,讨论了Zeno在NRG1+癌症中潜在的生物制剂许可申请(BLA)。由于当时的eNRGy试验和Early Access Program纳入的受试者均为NRG1+非小细胞肺癌和NRG1+胰腺癌患者。FDA建议Merus在两种路径(组织未定性(Tissue-agnostic)或肿瘤类型特异性)下入组更多的患者,以获得进一步的支持数据作为潜在的注册数据集。受此消息影响,Merus股价下跌了25%。
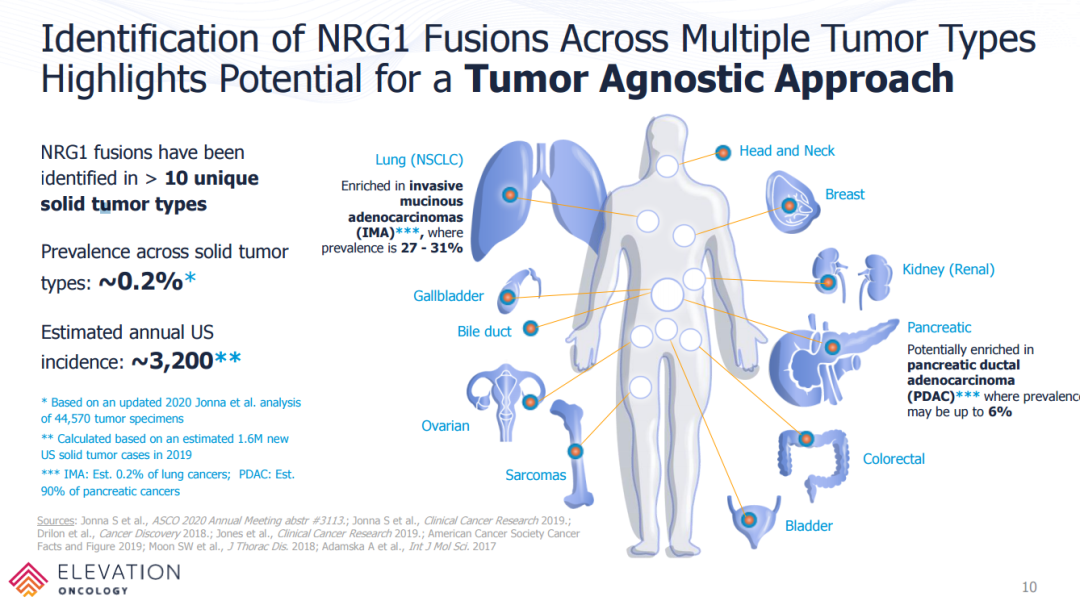
已在多种实体瘤中发现NRG1融合,包括肺癌、胰腺癌、胆囊癌、乳腺癌、卵巢癌、结肠直肠癌、神经内分泌瘤、胆管癌和肉瘤。NRG1融合约占实体瘤的0.2%。美国大于每年有3200例NRG1融合实体瘤新确诊患者。
目前全球尚无专门针对NRG1融合实体瘤的靶向疗法获批。临床上使用的标准疗法(SOC)或者超适应症用药对这类患者的效果不好,ORR较低,PR在13%~25%之间。PFS, DFS以及OS无显著获益。

近年来,多款不限癌种疗法获批用于治疗具有特定分子生物学特征的癌症患者。比如,礼来的RET抑制剂Retevmo(selpercatinib)获得美国FDA的加速批准,治疗携带RET基因融合的实体瘤患者;罗氏Rozlytrek(恩曲替尼),用于治疗NTRK基因融合阳性实体瘤患者;诺华Tafinlar(dabrafenib)+Mekinist(trametinib)组合获FDA批准用于治疗携带BRAF V600E突变实体瘤患者。基于多种癌症类型共享的分子生物学特征开发抗癌疗法代表着抗癌疗法开发的新策略。
不限癌种的药物开发策略与传统针对特定癌症类型的药物开发相比,一项重要的不同点是临床开发时会将在有限癌症类型中获得的疗效结果,推广到在临床试验中未纳入的癌症类型中。FDA指出,这一策略使药物在所有不同癌症类型中的疗效带来一定程度的不确定性。在某些情况下,这种不确定性是可接受的,并且可能为患者更快带来有效疗法。FDA也出台了相关指导原则《肿瘤学中组织组织未定性药物开发》。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


