近期科学家们在肠道微生物研究领域取得的重要研究成果!
来源:生物谷原创 2022-08-24 22:15
本文中,小编整理了近期科学家们发表的多篇重要研究成果,共同解读他们在机体肠道微生物研究领域取得的新进展!分享给大家!
本文中,小编整理了近期科学家们发表的多篇重要研究成果,共同解读他们在机体肠道微生物研究领域取得的新进展!分享给大家!
【1】Gastroenterology:揭示肠道微生物组在妊娠糖尿病发病过程中扮演的关键角色
doi:10.1053/j.gastro.2022.01.008
正常的妊娠往往涉及对母体肠道微生物组的重编程,其会通过不太明确的机制来促进母体机体的代谢变化,近日,一篇发表在国际杂志Gastroenterology上题为“Gestational insulin resistance is mediated by the gut microbiome-indoleamine 2,3-dioxygenase axis”的研究报告中,来自伊利诺伊大学等机构的科学家们通过研究识别出了导致妊娠糖尿病的肠道微生物组的改变。
研究者Brian Layden教授说道,生活在机体肠道中的细菌会影响机体患诸如妊娠糖尿病等疾病的风险,然而它们是如何做的?又会导致什么样的结果?研究人员并不清楚。这项研究中,研究人员进行了一项研究,识别出了肠道菌群中的特殊因素,这些因素或许会使得个体更易于患上某些疾病。文章中,研究人员研究了小鼠在整个孕期肠道微生物组和血浆代谢组变化的确切性质,为了帮助理解孕期影响机体代谢的肠道微生物组的改变,研究人员对接受人类粪便样本移植的小鼠进行了相关分析。

图片来源:https://www.gastrojournal.org/article/S0016-5085(22)00016-6/pdf
随后研究人员就能利用小鼠模型来识别吲哚胺-2,3-双加氧酶(IDO1,indoleamine-2,3-dioxygenase)在妊娠相关的胰岛素耐受性发生过程中所扮演的关键角色;胰岛素耐受性是2型糖尿病的主要特征,同时也存在于前驱糖尿病患者机体中,通过这种方法,研究人员识别出了在孕期水平会增加的代谢产物—犬尿氨酸。Layden说道,我们识别出了一种特殊的方式,即细菌会利用该方式与肠道上皮细胞相互作用,并调节代谢产物的产生方式,进而影响个体患诸如妊娠糖尿病风险等疾病的风险。
【2】Cell Host & Microbe: 高脂饮食促进代谢障碍的肠道微生物节律
doi:10.1016/j.chom.2022.03.030
现代社会昼夜节律紊乱导致代谢性疾病发病率上升。昼夜节律是行为和生物过程中的24小时振荡,部分由体内几乎所有细胞中都存在的核心昼夜时钟(CC)转录-翻译反馈环驱动。这些节律对主要代谢和免疫途径的调节至关重要,在这些途径中,近一半的小鼠转录组处于CC控制之下。当昼夜节律改变或不起作用时,就会出现不利的代谢后果,包括肥胖增加和胰岛素敏感性受损。
肠道微生物的昼夜振荡是宿主昼夜节律和新陈代谢的重要饮食驱动因素,确保了能量的最佳平衡。然而,饮食、微生物和维持肠道振荡的宿主因素之间的相互作用是复杂的,而且知之甚少。近日,芝加哥大学的研究者在“Cell Host & Microbe”杂志上发表了题为“High-fat diet disrupts REG3g and gut microbial rhythms promoting metabolic dysfunction”的文章,该研究揭示了恢复肠道微生物群感知特定宿主因子(如Reg3g)介导的饮食信号的能力可以用来改善代谢功能障碍。
在本研究中,研究者使用小鼠模型,报告宿主C型凝集素抗菌肽Reg3g与关键的回肠微生物以双向方式协调这些相互作用,而与肠道核心生物钟无关。高脂饮食是微生物振荡器的主要驱动力,微生物振荡器破坏宿主代谢的动态平衡,导致心律失常的宿主Reg3g表达,继而推动关键肠道微生物的丰富和振荡。这说明生物节律的跨界协调主要受饮食和宿主和微生物成分之间相互的传感器-效应器信号的影响,最终驱动新陈代谢。
【3】JAMA Oncol:肠道微生物组或会改变患者对癌症疗法的反应
doi:10.1001/jamaoncol.2022.0494
自古以来,机体的肠道微生物组就一直是大量细菌、病毒、者均和其它微生物的家园,其被认为会影响人类机体健康的多个方面,最近,测序技术研究显示,肠道微生物组或许在癌症疗法中国也发挥着重要作用,近日,一篇发表在国际杂志JAMA Oncology上题为“The Potential of the Gut Microbiome to Reshape the Cancer Therapy Paradigm: A Review”的综述文章中,来自布莱根妇女医院等机构的科学家们通过研究深入揭示了机体肠道微生物组和机体对免疫疗法、化疗和癌症手术等治疗手段所产生的反应之间的关联,相关研究结果或有望帮助开发新方法来靶向作用微生物组从而改善患者的治疗。
研究者Khalid Shah说道,我们都知道,健康的肠道对于机体的整体健康至关重要,我们的肠道之所以如此重要,因为我们经常将其称之为我们的“第二大脑”,近年来,科学家们开始意识到肠道的多方面作用,包括脑肠轴、肠道和机体免疫系统之间的关联,繁殖,肠道功能的紊乱或许就会对机体健康产生负面影响。
这篇研究报告中,研究人员报告了肠道微生物组在免疫疗法中所扮演的一种新角色,免疫检查点抑制剂和免疫检查点阻滞疗法是两种治疗癌症的新型疗法,但对这些形式治疗手段的反应在不同个体之间以及不同的癌症类型之间或许存在很大差异。一些研究发现,在对疗法产生应答的个体和无反应的个体机体的粪便中的细菌种类存在一定的差异,这或许就表明,不同的微生物组组成或许会影响个体的临床反应。而其它研究结果则发现,饮食和益生菌以及抗生素疗法和噬菌体都可以影响机体肠道微生物组的组成,反过来还会影响机体对免疫疗法的反应,尤其是,研究者强调了最近关于生酮饮食对癌症患者所产生影响的相关研究。
【4】Nature:科学家揭示影响人肠道微生物群的环境因素!
doi:10.1038/s41586-022-04567-7
肠道微生物群组成和功能的改变与多种疾病有关,包括胃肠道和代谢疾病以及精神障碍。肠道细菌和微生物途径对宿主代谢和免疫的影响,以及微生物群可以改变的事实,提高了人们对开发微生物组靶向疗法的兴趣。多种微生物组靶向疗法目前正在临床试验中,然而,健康微生物组的特征在很大程度上尚不清楚。此外,定义健康微生物组的能力受到研究之间粪便样本处理差异以及微生物组组成中巨大的个体间差异的阻碍,而对具有明确表型的大型标准化队列进行深入的综合分析仍然较少。近日,来自格罗宁根大学和格罗宁根大学医学中心的学者发表在Nature上发表的学术论文研究了遗传因素、暴露因素、生活方式和饮食如何塑造健康和疾病中的微生物组。
在本研究中,研究人员分析了来自2756个家庭的三代队列中的8208名荷兰个体的肠道微生物组中的细菌组成、功能、抗生素耐药性和毒力因子。该样本量覆盖了自举分析估计的微生物功能特征总数的90%以上。他们将这些与241个宿主和环境因素相关联,包括身心健康、药物使用、饮食、社会经济因素以及儿童和当前暴露体。
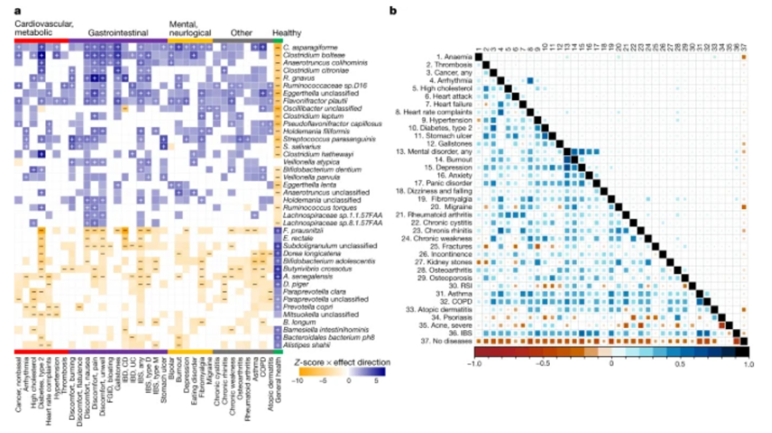
与疾病类别和健康状况相关的微生物组特征。
图片来源:Gacesa, R., et al. Nature (2022). doi:10.1038/s41586-022-04567-7
研究发现,肠道微生物群的组成在整个人群中变化很大,例如拟杆菌的相对丰度从5%到95%以上不等,鉴定了九种核心物种(Subdoligranulum sp.,Alistipes onderdonkii,Alistipes putredinis,Alistipes shahii,Bacteroides uniformis,Bacteroides vulgatus,Eubacterium rectale,Faecalibacterium prausnitzii和Oscillibacter sp.)。微生物组主要由环境和同居性塑造。只有约6.6%的类群是可遗传的,而约48.6%的类群的方差可以通过同居来显着解释。研究鉴定了微生物组与健康之间的2856种关联,其中1206个与细菌分类群的显着关联,1182个与微生物途径,390个与抗生素抗性基因和76个与细菌毒力因子的显着关联,发现看似无关的疾病具有与合并症无关的共同微生物组特征。此外,研究人员确定了微生物组特征与饮食,发现社会经济和早期生活以及当前暴露组之间的7519种关联,其中许多早期和当前因素与微生物组功能和组成显着相关。
【5】Nat Med: 科学家揭示肠道微生物与癌症免疫疗法反应相关性
doi:10.1038/s41591-022-01698-2
肠道微生物组已成为免疫检查点阻断(ICB)的肿瘤外在预测生物标志物。已有证据表明,肠道微生物组作为一种肿瘤外源性因素,与抗肿瘤对抗程序化细胞死亡蛋白-1 (PD-1)治疗的反应相关,微生物组调节可以提高对抗PD-1 ICB的反应性。然而,与临床结局相关的已发表微生物特征之间存在不一致。目前还不清楚微生物组是否对ICB治疗的有效性产生积极或消极的影响,以及在治疗过程中微生物组作用的最重要节点。为了解决这一问题,美国国家癌症研究所的研究人员进行了针对性研究,发现不同地理分布的肠道微生物特征(微生物型)与PD-1反应差异相关,并部分解释了队列之间的差异。相关研究结果发表在Nat Med上,题目为“Intestinal microbiota signatures of clinical response and immune-related adverse events in melanoma patients treated with anti-PD-1”。
身性和肠道脂多糖 (LPS)依赖性炎症状态。他们使用相同的生物信息学方法对来自新队列和四个已发表的PD-1治疗黑色素瘤患者的独立队列的微生物测序数据进行了荟萃分析。跨队列微生物组训练的机器学习始终如一地预测PD-1治疗的结果,尽管队列之间存在异质性。
时间-事件分析显示,基线微生物群组成与治疗开始后约1年的临床结局最佳相关。对组合数据的荟萃分析和其他生物信息学分析表明,与有利反应相关的细菌仅限于放线菌门和厚壁藻的毛螺菌科/瘤胃菌科微生物。相反,革兰氏阴性菌与炎症宿主肠道基因特征,血液中性粒细胞与淋巴细胞比值增加以及不良结局相关。两种微生物特征,富集了毛螺菌科和链球菌科微生物,分别与有利和不利的临床反应相关,并且具有不同的免疫相关不良反应。尽管队列之间存在异质性,但在批量校正的微生物组数据上训练的优化的全减一监督学习算法在所有队列中一致预测了程序性细胞死亡蛋白-1疗法的结果。具有不均匀地理分布的肠道微生物群落(微生物型)与有利和不利的结果相关,导致队列之间的差异。
【6】Nature:肠道微生物代谢物可影响大脑活动并导致焦虑行为!
doi:10.1038/s41586-022-04396-8
动物行为受环境中各种感官和分子因素的影响。胃肠道是受环境分子影响的一个主要部位,在这里,饮食成分被微生物群化学转化,肠道衍生的代谢物扩散到包括大脑在内的所有器官。前期研究表明,在小鼠中,肠道微生物群影响行为,调节肠道和大脑中的神经递质产生,并影响大脑发育和髓鞘形成模式。目前,尽管介导肠-脑相互作用在体液或神经元连接中起着重要作用,但是其相互作用机制仍不清楚。加州理工学院生物与生物工程系的学者曾在不典型神经发育的小鼠模型中检测到微生物代谢物4-乙基苯基硫酸酯(4EPS)的水平升高,他们进一步研究了这一肠道微生物代谢物对大脑活性的影响。相关研究结果发表在Nature上,文章题目为“A gut-derived metabolite alters brain activity and anxiety behaviour in mice”。
在这项研究中,研究人员从肠道微生物中鉴定了介导饮食中酪氨酸转化为4-乙基酚(4EP)的生物合成基因,以及生物工程肠道细菌选择性地产生4EPS的基因。他们利用缺乏微生物群的无菌(GF)小鼠,并在不同的GF小鼠群中定植了两种工程菌株,构建了4EP+或4EP-小鼠。通过建立一个简化的动物模型,重现了暴露于肠道微生物代谢物的行为改变的自然路径。为了研究4EP(S)对小鼠大脑的影响,学者们进行了功能超声成像(fUSi)——一种测量静息状态脑血容量变化的体内方法,以评估功能连通性。研究发现,4EPS进入大脑,4EPS的升高与小鼠大脑各区域间异常的功能连接有关。
【7】Sci Rep:揭示人类机体的遗传特性影响肠道微生物组功能的分子机制
doi:10.1038/s41598-022-07632-3
有关宿主机体遗传特性对肠道微生物组组成影响的研究主要关注个体单核苷酸多态性(SNPs)对机体肠道微生物组组成的影响,而并未考虑其所产生的集体影响或对微生物组具体功能的影响。近日,一篇发表在国际杂志Scientific Reports上题为“Collective effects of human genomic variation on microbiome function”的研究报告中,来自康奈尔大学等机构的科学家们通过研究深入揭示了人类机体遗传特性影响机体肠道微生物组功能的分子机制,同时该研究还扩大了人类遗传特性在塑造微生物组方面所扮演的角色或功能。
组成人类肠道微生物组的数万亿个有机体会对机体的代谢功能、疾病和整体健康产生极大的影响,然而研究人员并不清楚肠道微生物组如何以及在多大程度上反过来会被人类宿主机体的基因组所塑造。
研究者Ilana Brito表示,这篇研究报告中,我们采用了一种新方法来分析宿主-微生物组之间的遗传相互作用,并且揭示了许多实例来阐明,人类宿主机体的遗传组成会直接影响肠道微生物组的功能表现。当一种疾病或表型是由单一的基因突变所引起,那么找到主要负责的基因或许是一个相对简单的过程,但一整套基因之间可以发生相互作用,从而导致疾病或其它表型表达,而这或许是一种更为复杂的机制,在人类基因组中,不同人群之间存在许多连续的变异,甚至在同一个人的成对染色体中也会存在这种现象。
【8】Nat Med:肠道微生物可预测晚期非小细胞肺癌生存率!
doi:10.1038/s41591-021-01655-5
靶向PD-1-PD-L1相互作用的免疫检查点抑制剂(ICIs)的发展已经改变了晚期NSCLC1患者的治疗前景。对既往治疗的晚期非小细胞肺癌(NSCLC)患者进行的试验表明,与标准化疗相比,PD-1-PD-L1阻断治疗后的总生存期(OS)更高。然而,只有少数(35%)患者从ICI的持续反应中受益。大多数非小细胞肺癌患者出现原发性或继发性耐药性,或偶尔出现疾病的快速加速,即超进展。因此,迫切需要了解ICI的耐药机制,以识别新的、强有力的耐药生物标志物。
已有研究表明,在癌症患者中,肠道微生物群的组成在影响外周免疫紧张和ICIs有效性方面具有生物学意义,肠道微生物群可能有助于ICIs16的免疫刺激作用模式。微生物群的多样性和特定细菌的存在,如肠道嗜粘液细菌Akkermansia muciniphila (Akk)或瘤胃球菌或双歧杆菌属,与ICI的临床反应改善和系统免疫强度增加有关。近日,发表在Nat Med上的一篇题为“Intestinal Akkermansia muciniphila predicts clinical response to PD-1 blockade in patients with advanced non-small-cell lung cancer”的研究性论文发现Akk可以预测晚期NSCLC患者的12个月生存率!
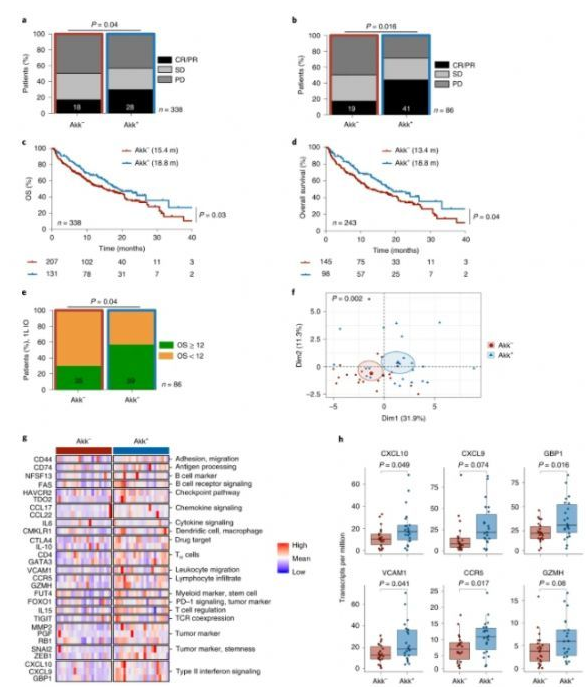
粪便中的Akk与ICI临床受益有关。
图片来源:Derosa,L.,et al. Nat Med, doi:10.1038/s41591-021-01655-5
在本研究中,研究人员对338名接受一线或二线ICIs治疗的晚期NSCLC患者进行了基于宏基因组学的微生物组分析,前瞻性验证了粪便Akk的预测价值。研究结果显示,肠道Akk与客观缓解率和总生存率的增加相关,与PD-L1表达、抗生素和功能状态无关。同时,研究人员利用小鼠模型验证了该结论。研究进一步探讨了肠道Akk和肿瘤组织(鳞状和非鳞状NSCLC)之间的相互作用,结果表明Akk的存在与非小细胞肺癌患者肠道微生物群和肿瘤微环境中重要的、潜在的预后相关的变化有关。
【9】Nat Commun:酒精或许会以一种我们想象不到的方式来改变机体的肠道微生物组
doi:10.1038/s41467-022-31973-2
长期饮酒是诱发肝脏损伤和死亡的主要原因,在美国每年大约有3万名个体会因酒精性肝脏疾病(比如肝硬化)而死亡,过度饮酒的负面影响之一就是其会对肠道微生物组产生不利影响,尽管这种情况到底是如何发生的,研究人员目前尚未阐明,因为机体所摄入的大部分酒精都是通过口腔和胃部吸收的,并不会到达肠道中。
近日,一篇发表在国际杂志Nature Communications上题为“Acetate reprograms gut microbiota during alcohol consumption”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究就对上述问题进行了解答,即肠道微生物群的重编程或许是由肝脏中所产生的乙酸盐扩散到肠道中所引起的,同时其会在肠道中成为支持细菌生长的碳源。
研究者Karsten Zengler博士表示,你可以认为这有点像在花园里倾倒肥料,其所导致的结果就是引起不平衡的生物性增长的爆发,从而使一些菌群受益,而不会让其它菌群受益。乙酸盐是一种在细胞代谢中所使用的营养物质,其在机体的食欲调节、能量消耗和免疫反应中均扮演着关键角色,在适度水平下其能促进机体的总体健康,包括从改善机体心脏功能到增强红细胞的产生以及记忆功能等;如果水平过高的话就会引起与疾病相关的代谢改变,包括癌症等。在这项最新研究中,研究者Zengler及其同事利用一种特殊分子来喂食小鼠,这种分子能在啮齿类动物的肠道中被分解为三种乙酸盐,研究者指出,动物肠道中的微生物群能被额外的乙酸盐所改变,而其方式类似于他们在给小鼠喂食酒精时所观察到的情况,但对动物的肝脏却并不会产生任何损伤效应。
【10】Nat Med:健康的肠道微生物组或能改善癌症免疫疗法的治疗成功率
doi:10.1038/s41591-022-01695-5
肠道微生物组的组成与机体对免疫检查点抑制剂(ICI)疗法的反应直接相关,但科学家们对特定微生物组特征与ICIs的临床效益之间的关联的共识非常有限。近日,一篇发表在国际杂志Nature Medicine上题为“Cross-cohort gut microbiome associations with immune checkpoint inhibitor response in advanced melanoma”的研究报告中,来自伦敦大学国王学院等机构的科学家们通过进行迄今为止最大规模的研究证实了肠道微生物组和机体对黑色素瘤癌症免疫疗法的反应直接相关。
研究者Karla Lee表示,对非常有限数量的患者的临床前研究结果表明,作为免疫系统的关键调节子,肠道微生物组在每位患者机体对癌症免疫疗法的反应上扮演着关键角色,尤其是在黑色素瘤的情况下,本文研究或会对肿瘤学和一般医学研究产生非常重要的影响。微生物组是生活在机体肠道中的一组微生物群落,其能通过膳食改变、新一代益生菌和粪便移植的方式来改变,从而就会修饰微生物组对宿主机体免疫系统的作用方式。理解微生物组的特征或有望帮助临床医生在患者接受疗法之前改变其机体的微生物组,不到50%的患者会对黑色素瘤免疫疗法产生积极性的反应,因此找到能增加积极性反应患者数量的策略就显得至关重要了。
这项研究汇集了来自英国、荷兰和西班牙5个临床研究中心最大的黑色素瘤患者队列以及样本,研究人员进行了大规模的宏基因组研究(对肠道微生物组进行测序),旨在调查是否肠道微生物组的组成和功能与机体对免疫疗法反应之间存在一定的关联。研究结果证实了一种非常复杂的关联,其主要涉及不同患者群体机体中的不同细菌种类,研究者表示,三种类型的细菌似乎都与患者机体出现更好的免疫反应有关,即假小链双歧杆菌(Bifidobacterium pseudocatenulatum)、罗氏菌属(Roseburia spp)和Akkermansia muciniphila。另一项研究发现则是,微生物组自身或许还受到了多种因素的强烈影响,包括患者的体质、使用质子泵抑制剂和饮食等,这些饮食或许应该在未来的纵向研究中予以考虑。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


