如果能“冻住癌细胞的脚”?RSOS:“冻结”透明质酸让癌细胞休眠,终结术后复发噩梦
来源:生物谷原创 2025-09-10 16:49
只要 “冻结” 大脑中一种叫透明质酸(HA) 的分子,让它失去灵活性,就能让胶质母细胞瘤细胞从 “侵袭状态” 切换到 “休眠状态”,甚至破解术后复发的难题。
胶质母细胞瘤(GBM)是成人最凶险的恶性脑肿瘤,美国癌症协会数据显示其五年生存率仅 15%,而更残酷的是,患者中位生存期不足 15 个月——肿瘤像 “藤蔓” 一样通过脑血管和神经间隙扩散,即使手术切除主病灶,残留的癌细胞仍会在数月内复发,放疗和化疗也难以穿透大脑的保护屏障。
近日,剑桥大学团队在《Royal Society Open Science》发表突破性研究,终于找到阻止其扩散的关键:只要 “冻结” 大脑中一种叫透明质酸(HA) 的分子,让它失去灵活性,就能让胶质母细胞瘤细胞从 “侵袭状态” 切换到 “休眠状态”,甚至破解术后复发的难题。
透明质酸是大脑细胞外基质的 “主力成分”,在胶质母细胞瘤患者的肿瘤微环境中,其浓度比正常脑组织还高,且常伴随降解(透明质酸酶 HYAL2 过表达,与患者生存期负相关)。过去学界认为,低分子量透明质酸(LMW-HA,10-250 kDa)促进癌症进展,高分子量透明质酸(HMW-HA,>500 kDa)维持组织稳定,但总有例外——剑桥团队发现,真正决定癌细胞行为的不是 HA 的分子量,而是它的分子灵活性:就像钥匙需要能弯折才能插入锁孔,HA 只有具备足够灵活性,才能与癌细胞表面的CD44 受体结合,触发扩散信号。
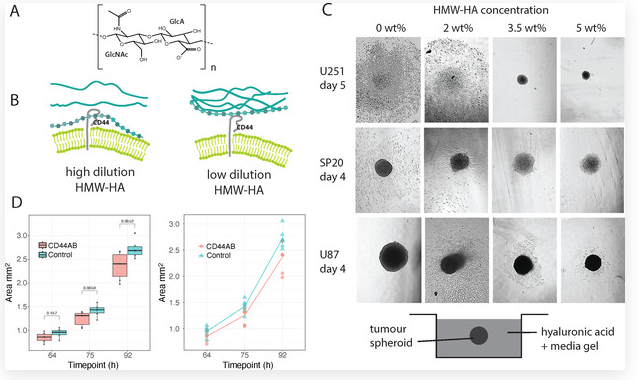
不同高分子量透明质酸浓度下的癌球体的行为
为验证这一猜想,研究团队用三种细胞构建 3D 球状体模型(U251、U87 胶质母细胞瘤细胞,以及患者手术切除的 SP20 肿瘤起始细胞),分别放入不同浓度的 HMW-HA 凝胶中。
结果令人意外:2wt% 的 HMW-HA 凝胶中,所有细胞球在 4 天内就大量扩散,细胞长出细长的 “侵袭伪足”;而 5wt% 的 HMW-HA 凝胶中,仅少数细胞分散,且 6 周内毫无变化——癌细胞既不生长也不死亡,进入了休眠状态。更关键的是,在 viscosity(黏度)更低的普通培养基中,U87 细胞几乎不扩散,说明不是 “物理阻碍” 而是 HA 的特性决定扩散,推翻了 “低黏度利于迁移” 的猜想。
为弄清 HA 灵活性的作用,团队用核磁共振(NMR)光谱学追踪 HA 的分子运动:HMW-HA 要与 CD44 强结合,需要在数十纳秒内扭曲出特定构象( backbone 波动幅度超 30°,才能契合 CD44 的结合域)。2wt% 的 HMW-HA 中,分子 entanglement(缠绕)少,能自由调整构象,NMR 显示其甲基和糖环的 ¹H 自旋 - 晶格弛豫时间(T₁)差异显著,证明有纳秒级灵活性;而 5wt% 的 HMW-HA 分子缠绕紧密,无法完成构象变化,T₁值一致,意味着无法与 CD44 有效结合。当用抗体阻断 CD44 后,2wt% 凝胶中的 U87 细胞迁移面积显著缩小,92 小时后差异达统计学意义,直接证实 CD44 是 HA 介导扩散的 “关键受体”。
进一步的蛋白质组分析揭开了背后的信号通路:2wt% HMW-HA 中,癌细胞的 “侵袭装备” 全面激活 ——fascin-1(稳定 actin 束)、filamin A/C(交联 actin)等侵袭伪足相关蛋白上调 2-200 倍,MMP2 和 MMP14(降解基质的蛋白酶)也显著增加,细胞形成 “集体迁移的细胞片”;而 5wt% HMW-HA 中,Notch-2 通路被激活,dynamin-2(内吞关键蛋白)、nicastrin(γ- 分泌酶组件)等蛋白表达升高,就像给癌细胞按下 “休眠键”,这与成年大脑中 Notch-2 维持神经干细胞静息的机制如出一辙。
为验证 “灵活性而非浓度” 是关键,团队合成了交联透明质酸(oxHA) ——给 HMW-HA 加上醛基,让它与细胞外基质蛋白交联,失去灵活性。即使是 2wt% 的 oxHA 与 HMW-HA 混合凝胶,U87 细胞也完全不扩散,且蛋白质表达与 5wt% HMW-HA 一致,均激活 Notch-2 通路。这说明只要 HA 失去灵活性,无论浓度高低,都能让癌细胞休眠。
这项研究还解答了临床一大困惑:为何胶质母细胞瘤常在术后复发?团队推测,手术引发的脑水肿会稀释脑组织中的 HA,原本紧密缠绕的 HMW-HA 变得松散、灵活,反而激活残留癌细胞的扩散信号。而新的治疗思路恰恰相反——不直接攻击癌细胞,而是 “改造其生存环境”:通过药物让 HA 交联、失去灵活性,或抑制 HA 的分子运动,就能让癌细胞休眠,避免扩散和复发。
目前,团队已在细胞模型中验证了这一策略的有效性,下一步计划在动物模型中测试,并探索可用于临床的 “HA 稳定剂”。正如研究负责人 Melinda Duer 教授所说:“我们不需要杀死癌细胞,只需改变它们周围的 HA 状态——当 HA 无法灵活结合 CD44,癌细胞就会放弃侵袭,乖乖进入休眠。” 这一发现不仅为胶质母细胞瘤带来新希望,还可能适用于乳腺癌、结直肠癌等依赖 HA 扩散的实体瘤,为 “靶向肿瘤微环境” 的治疗开辟了新方向。(生物谷Bioon.com)
参考文献:
Uliana Bashtanova,Agne Kuraite,Rakesh Rajan, et al. Molecular flexibility of hyaluronic acid has a profound effect on invasion of cancer cells, Royal Society Open Science (2025). DOI:10.1098/rsos.251036
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


