FDA批准首款CRISPR基因编辑疗法用于治疗第二种疾病——β地中海贫血
来源:生物世界 2024-01-17 14:57
Casgevy疗法的获批,并不是旅程的终点,而是一个期待已久的开始。
刚刚,美国食品和药物监督管理局(FDA)批准首款基于CRISPR技术的开创性基因编辑疗法Casgevy用于治疗第二种疾病——12岁及以上输血依赖性β-地中海贫血(TDT)。
这是一项意料之中的批准,去年12月,Casgevy疗法被FDA批准用于治疗12岁及以上伴有复发性血管闭塞危象的镰状细胞病(SCD),这也是FDA批准的首款基于CRISPR技术的基因编辑疗法。

Casgevy是由诺贝尔化学奖得主、CRISPR 基因编辑先驱 Emmanulle Charpentier 创立的 CRISPR Therapeutics 公司和 Vertex Pharmaceuticals 公司合作开发的一款用于治疗镰状细胞病和β-地中海贫血的基于CRISPR-Cas9基因编辑的自体细胞疗法,能够帮助患者有效摆脱输血和血管阻塞危机。

此前,Casgevy疗法的临床试验结果于2020年12月发表在了《新英格兰医学杂志》(NEJM)期刊,论文题为:CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia。

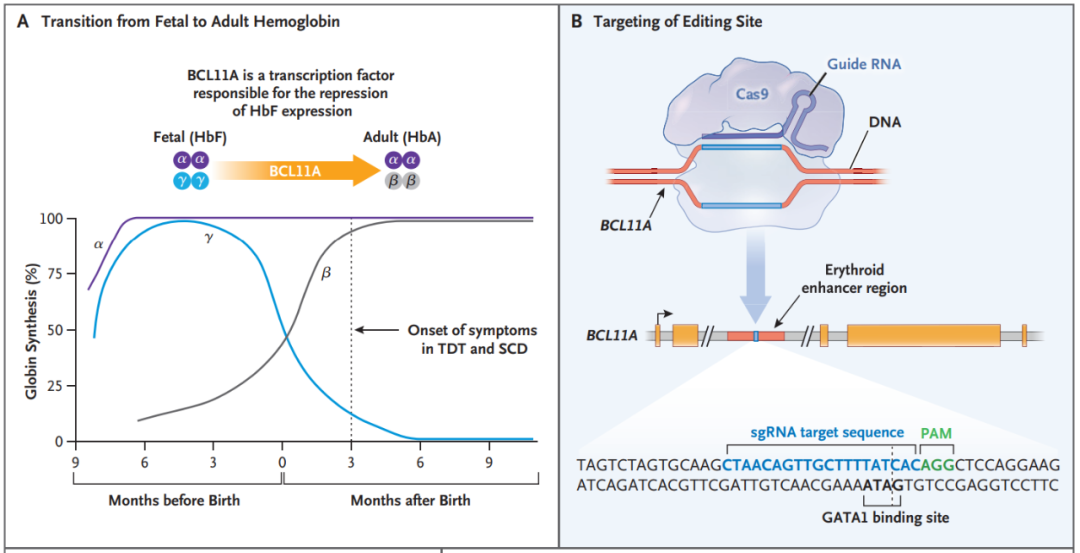
BCL11A是一种转录因子,可抑制红系细胞中的γ-珠蛋白和胎儿血红蛋白表达。因此,靶向抑制BCL11A在理论上可以重新激活γ-珠蛋白表达,从而治疗β-地中海贫血和镰状细胞病。
研究团队从健康供体获得了CD34+造血干细胞和祖细胞,然后通过电穿孔导入特异性靶向BCL11A增强子的CRISPR-Cas9基因编辑系统。检测结果表明该位点的等位基因约有80%被编辑,且没有脱靶编辑的迹象。
在这篇论文中,研究团队对1名β-地中海贫血患者和1名镰状细胞病患者回输了经过CRISPR-Cas9编辑BCL11A增强子的自体CD34+细胞。治疗后18个月,两名患者的骨髓和血液中等位基因编辑水平仍保持较高,骨髓中保持超过76%的编辑效率,血液中的编辑效率也保持在60%。且患者不再依赖输血,循环血液中表达胎儿血红蛋白HbF的细胞占比达到99%。
目前公布的数据显示,已有45名镰状细胞病患者接受了Casgevy疗法,其中有29人的治疗时间足以得到中期结果,这29人中有28人在治疗后至少一年内缓解了疼痛发作。还有54名严重地中海贫血患者接受了Casgevy疗法的治疗,其中有42人的治疗时间足以得到中期结果,这42人中有39人在治疗后至少一年内不再需要输血,其余3人对输血的需求减少了70%以上。已有44名β-地中海贫血患者接受了Casgevy疗法,其中有42人在1.2-37.2个月的随访时间里不再需要输血,其他2人的输血频率分别降低75%和89%。
一方面,基于CRISPR基因编辑技术的基因疗法去的了惊人的进展,此次获得FDA批准是一个真正意义上的里程碑时刻。但如何开发出常规、可扩展、安全、价格合理且负担得起的基因编辑疗法,成为下一个关键挑战。
据悉,该疗法的定价高达220万美元。如此高昂的售价,如何让世界各地,尤其是非洲地区数以百万计的镰状细胞病(SCD)患者获益,是个值得思考的问题。
诺奖得主、CRISPR基因编辑先驱 Jennifer Doudna 教授曾表示,一次性体内注射、无需体外操作和骨髓移植的基因编辑疗法,终将成为可能。
Casgevy疗法的获批,并不是旅程的终点,而是一个期待已久的开始。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


