J Hematol Oncol:突破T细胞白血病治疗瓶颈——双靶点CAR-T细胞有望带来新希望
来源:生物谷原创 2025-08-11 10:11
来自西班牙何塞普-卡雷拉斯白血病研究所等机构的科学家们通过研究聚焦于两个非泛T抗原——CCR9和CD1a,同时开发并验证了一种双靶点CAR-T细胞治疗策略。
T细胞急性淋巴细胞白血病(T-ALL)是一种高度侵袭性的血液系统恶性肿瘤,约占儿童急性淋巴细胞白血病(ALL)的15%、成人ALL的25%。尽管儿童患者的治愈率可达80%,但成人患者的长期生存率仍低于40%。更令人担忧的是,超过一半的患者会在治疗后复发或对标准治疗无效,复发/难治性T-ALL的中位总生存期仅为8个月左右。目前治疗手段主要依赖高强度的化疗和异基因造血干细胞移植(alloHSCT),但毒性大、失败率高,临床亟需更安全有效的靶向治疗策略。
与B细胞恶性肿瘤相比,T-ALL的免疫治疗进展缓慢,由于恶性T细胞与健康T细胞在表面抗原表达上高度相似,传统的CAR-T细胞疗法面临“自相残杀”(fratricide)和T细胞发育不全(T cell aplasia)等致命问题。近年来,研究者尝试通过基因编辑技术敲除CD7等泛T抗原,尽管取得了一定进展,但技术复杂、监管难度大,且仍需依赖alloHSCT进行挽救治疗,因此寻找安全、特异、非泛T抗原的靶点成为T-ALL免疫治疗的关键突破口。
近日,一篇发表在国际杂志Journal of Hematology & Oncology上题为“CAR-T cells targeting CCR9 and CD1a for the treatment of T cell acute lymphoblastic leukemia”的研究报告中,来自西班牙何塞普-卡雷拉斯白血病研究所等机构的科学家们通过研究聚焦于两个非泛T抗原——CCR9和CD1a,同时开发并验证了一种双靶点CAR-T细胞治疗策略,旨在克服T-ALL治疗中的抗原逃逸、制造困难和免疫毒性等问题,相关研究或具有重要的临床转化价值。
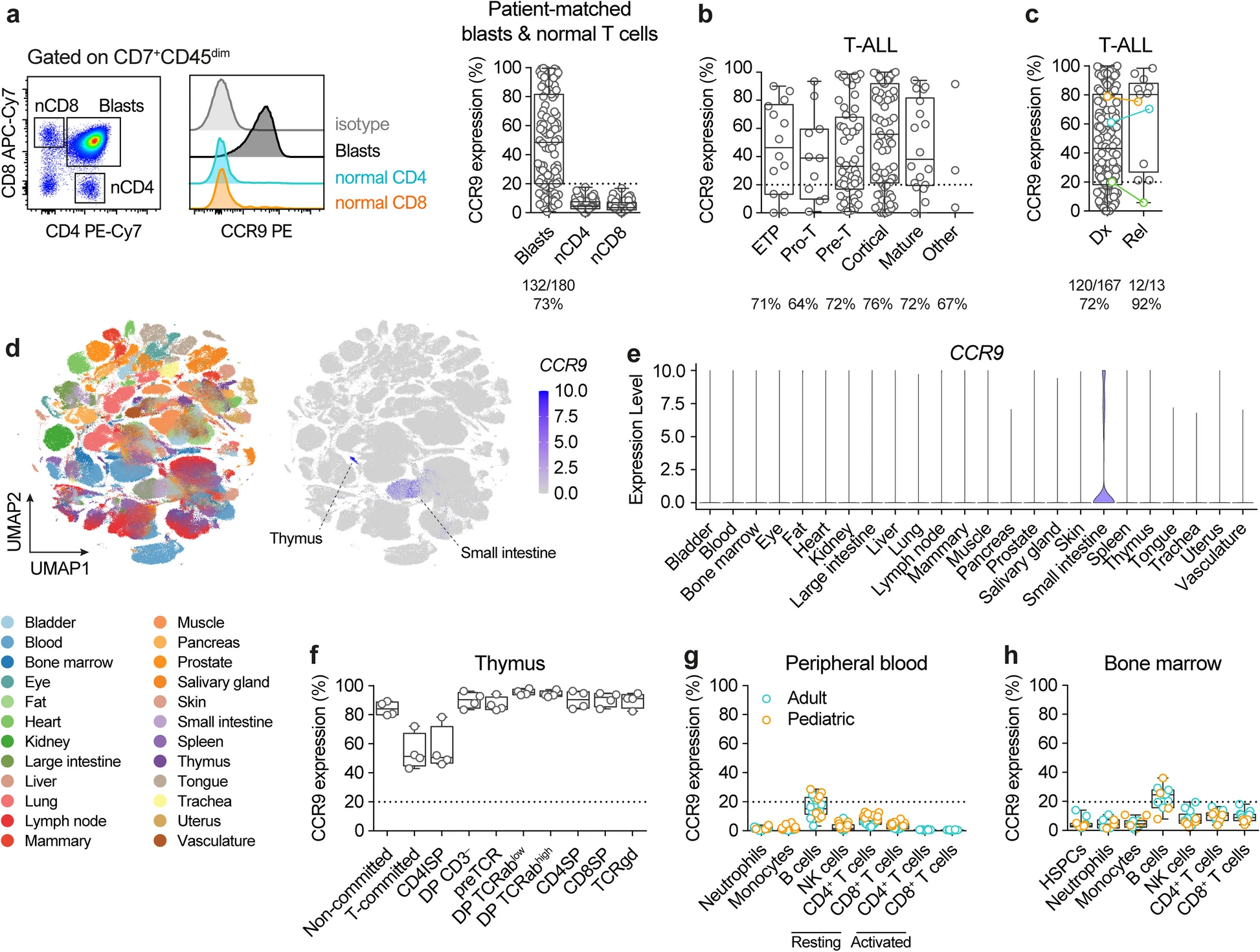
文章中,研究人员首先对180例T-ALL患者样本进行免疫表型分析,结果发现CCR9在73%的患者中高表达,尤其在复发样本中表达率高达92%。更重要的是,CCR9在正常T细胞、造血干细胞及其他组织中几乎不表达,仅在部分胸腺细胞和肠道淋巴细胞中微弱表达,具备良好的安全性。CD1a则主要在皮质型T-ALL中表达,约占所有T-ALL的30%。两者联合可覆盖86%的患者并能显著扩大治疗人群。
在实验设计上,研究者采用杂交瘤技术筛选出高亲和力的CCR9单克隆抗体,并构建出鼠源和人源化的单链抗体(scFv),进一步将其嵌入第二代CAR结构中,构建出了三种CCR9-CAR-T细胞(鼠源M、人源化H1和H2)。通过体外细胞毒性实验发现,H2型CAR-T细胞在杀伤CCR9阳性T-ALL细胞系(如MOLT4)和患者来源异种移植模型(PDX)中表现出最强的活性和特异性,且无明显自相残杀现象。
CCR9或能作为T细胞急性淋巴细胞白血病中的一种安全且特异性的靶点
为进一步验证其体内疗效,研究者在NSG小鼠中建立了T-ALL PDX模型,分别注射CCR9阳性白血病细胞并给予不同CAR-T细胞治疗,结果显示,CCR9 H2 CAR-T细胞可显著抑制肿瘤进展,80%的小鼠实现完全缓解且优于其它组别。在此基础上,研究人员进一步开发了同时能靶向CCR9和CD1a的双靶点CAR-T细胞。通过共转导、串联CAR和双顺反子CAR三种策略进行构建和比较,最终发现,共转导策略(即分别转导CCR9和CD1a CAR)在杀伤效率和抗原覆盖面上表现最优,实验结果表明,双靶点CAR-T细胞可有效清除表达任一抗原的白血病细胞并能避免单靶点治疗导致的抗原逃逸。
此外,研究人员还模拟了T-ALL中常见的抗原异质性,通过CRISPR/Cas9技术构建CCR9和CD1a表达水平不同的细胞系并混合成异质性群体。结果显示,双靶点CAR-T细胞仍能高效清除所有亚群,而单靶点CAR-T细胞则出现明显的抗原逃逸现象。最后,研究者从T-ALL患者样本中成功制备出CCR9/CD1a双靶点CAR-T细胞,并在体外验证其对自体白血病细胞的强大杀伤能力,进一步证明了该策略的临床可行性。
综上,本文研究首次系统性地验证了CCR9作为T-ALL治疗靶点的安全性与有效性,并创新性地提出CCR9/CD1a双靶点CAR-T细胞治疗策略,成功解决了T-ALL免疫治疗中面临的三大核心难题:抗原逃逸、制造复杂性和免疫毒性。CCR9的高表达率和良好安全性使其成为理想的CAR-T靶点,而CD1a的联合使用进一步扩大了治疗覆盖面。双靶点策略不仅能提高患者的治疗效率,还能有效防止因抗原下调导致的复发风险。此外,该策略避免了基因编辑带来的监管和安全性问题且简化了制造流程,有望实现自体CAR-T细胞的广泛应用。
未来,随着相关临床试验的推进,这一双靶点CAR-T细胞疗法有望成为复发/难治性T-ALL患者的重要治疗选择,甚至为其他CCR9阳性实体瘤的免疫治疗提供新思路。(生物谷Bioon.com)
参考文献:
Tirado, N., Fidyt, K., Mansilla, M.J. et al. CAR-T cells targeting CCR9 and CD1a for the treatment of T cell acute lymphoblastic leukemia. J Hematol Oncol 18, 69 (2025). doi:10.1186/s13045-025-01715-0
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


