2020年1月HIV研究亮点进展
来源:本站原创 2020-01-31 23:59
即将过去的1月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
2020年1月31日讯/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
即将过去的1月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
1.Lancet HIV:新研究发现HIV“热点地区”不一定是新感染的主要驱动因素
doi:10.1016/S2352-3018(19)30378-9
在一项新的研究中,来自英国帝国理工学院等研究机构的研究人员发现称为“热点地区(hotspot)”的HIV高发地区并不一定在更广泛的人群中促进这种流行病。相关研究结果于2020年1月14日在线发表在Lancet HIV期刊上,论文标题为“Quantifying HIV transmission flow between high-prevalence hotspots and surrounding communities: a population-based study in Rakai, Uganda”。
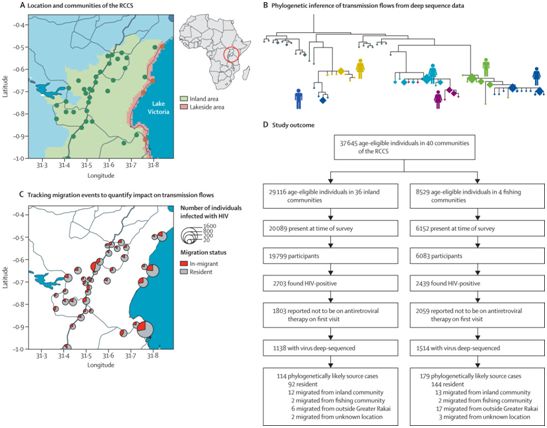
这项研究是在乌干达维多利亚湖沿岸的“热点”捕鱼社区进行的,在那里大约有40%的人群感染了HIV,是世界上HIV感染率最高的热点地区之一。这些研究人员绘制了在这些热点捕鱼社区与HIV感染率低得多的更大内陆社区之间如何传播疾病的图谱。与预期相反的是,他们发现更多的HIV感染是由HIV感染率较低的内陆社区而不是HIV热点地区造成的。
论文第一作者、帝国理工大学数学系研究员Oliver Ratmann博士说,“我们的发现表明HIV疾病(即艾滋病)动态变化并不像看起来的那样明显,并建议不要将热点地区等同于导致HIV在非洲传播的人群,也不要给它们贴上污名。”
但是,这些研究人员也提醒道这只是一个案例研究,针对其他地区的类似研究可能会揭示不同的模式。他们目前正在维多利亚湖岸更北的地方重复这项研究,以测试这些发现的可靠性。
2.Nature:科学家们探究终结全球HIV流行病的策略
doi:10.1038/s41586-019-1841-8
随着新的传染病在世界范围内不断涌现,研究人员并未忘记已存在很多年的敌人,并加倍努力来消灭它们。对于HIV病毒及其导致的免疫免疫缺陷综合征(AIDS)而言,他们已经开始寻找治愈方法。
南非夸祖鲁纳塔尔大学的Thumbi Ndung’u、比尔和梅琳达•盖茨基金会的Joseph M. McCune和美国加州大学旧金山分校的Steven G. Deeks近期在Nature期刊上发表了一篇标题为“Why and where an HIV cure is needed and how it might be achieved”的文章,评估了可能根除HIV的药物管线(pharmaceutical pipeline)中潜在的候选药物。他们的目的很简单:强调为什么需要治愈,哪里需要治愈,以及这一点可能如何实现。
这三名研究人员的一个重要结论是,许多HIV治愈研究正在HIV/AIDS患者在人口统计中不占主导地位的国家中开展。Deeks写道,“治愈研究仍然集中在HIV负担低、资源丰富的国家的学术医学中心。”他、Ndung’u和McCune认为最前沿的创新必须考虑到最需要它的人的需求和经济状况。
3.Nature子刊:新研究有助抵抗HIV和HBV
doi:10.1038/s42003-019-0706-x
在美国有100多万HIV感染者。在一项新的研究中,来自美国佛罗里达州立大学医学院的研究人员首次确定了两种广泛使用的抗病毒药物如何抑制病毒的机制。这一发现有望为世界上感染了HIV的3600多万人和其他遭受乙肝病毒(HBV)慢性感染的人打开了新的更有效的治疗选择之门。相关研究结果近期发表在Communications Biology期刊上,论文标题为“Elucidating molecular interactions of L-nucleotides with HIV-1 reverse transcriptase and mechanism of M184V-caused drug resistance”。
在这篇论文中,论文通讯作者、佛罗里达州立大学医学院的Zucai Suo教授及其同事们还提供了理解单个HIV-1突变如何可以让抗HIV药物恩曲他滨(emtricitabine)和拉米夫定(lamivudine)失去疗效的关键。这些药物为制造出它们的公司每年赢取了数十亿美元的销售额,然而产生耐药性的患者的比例为治疗这种疾病带来严重而危险的障碍。
这篇论文解释了一类称为L-核苷类逆转录酶抑制剂(L-nucleoside reverse transcriptase inhibitor, L-NRTI)的HIV药物是如何发挥作用的。L-NRTI阻断了HIV复制时需要的一种酶,不过它们是通过盲法临床试验发现的。关于L-NRTI作用机制的重要细节仍然是一个谜,也是研究它们的科学家们之间的争论焦点。
这篇论文还解释了在某些患者人群中发现的突变如何导致对抗病毒药物L-NRTI产生耐药性。Suo说,“患者、HIV科学家和医生都将受益于L-NRTI。HIV科学家和制药公司如今将知道它们的作用机制,并将能够利用这类药物设计出更好的药物。他们将能够在这篇论文描述的机制上进行轻微的调整,以获得更好和更强大的治疗选择。”
4.MMWR:在暴露于HIV的妊娠中,神经管缺陷的患病率为7.0/10000
doi:10.15585/mmwr.mm6901a1
在一项新的研究中,来自美国疾病预防控制中心(CDC)的Jennita Reefhuis博士及其同事们报道在暴露于HIV的妊娠中,每10000例活产中有7.0例神经管缺陷(neural tube defect),这种患病率与一般人群的患病率相似。相关研究结果发表在2020年1月10日的Morbidity and Mortality Weekly Report期刊上,论文标题为“Neural Tube Defects in Pregnancies Among Women With Diagnosed HIV Infection — 15 Jurisdictions, 2013–2017”。

这些研究人员使用了两个CDC HIV/AIDS监测计划的相关数据,估算了美国的15个司法管辖区在2013年至2017年期间的神经管缺陷总体患病率、在暴露于HIV的妊娠中的神经管缺陷患病率以及出生缺陷。
这些研究人员发现,在诊断出遭受HIV感染的女性中,神经管缺陷的患病率为每10000例活产中有7.0例。这种神经管缺陷患病率与这15个司法管辖区的一般人群的患病率相似(每10000例活产中有7.0例),而且也与美国根据24个州的数据估算的患病率(每10000例活产中大约有8例)相似。
5.Nat Commun:新研究揭示免疫系统检测和应对HIV感染新机制
doi:10.1038/s41467-019-13837-4
在一项新的研究中,来自挪威科技大学、奥斯陆大学和中国清华大学的研究人员发现了免疫系统以一种以前未知的方式检测和应对HIV感染,这可能提高治愈这种疾病的机会。相关研究结果近期发表在Nature Communications期刊上,论文标题为“Sensing of HIV-1 by TLR8 activates human T cells and reverses latency”。
当HIV进入体内时,它会感染免疫系统用来抵抗它的免疫细胞,即CD4 辅助性T细胞(CD4 T细胞)。一旦这些T细胞遭受感染,它们就无法保护身体免受其他疾病或感染。因此,由HIV感染引起的疾病称为获得性免疫缺陷综合征(AIDS)。
当辅助性T细胞没有与HIV病毒上的配体相匹配的受体时,它就不能主动感染这种T细胞。相反,这种病毒可以被捕获在细胞中称为内体(endosome)的囊泡内。过去,科学家们认为,这种特定的途径---HIV被捕获在辅助性T细胞的内体中,而辅助性T细胞破坏了内体中的内含物---是HIV感染的死胡同。毕竟,辅助性T细胞实际上没有受到感染,并且它们的内体破坏了这种病毒。但是如今,这些研究人员发现了先前未描述的免疫反应,这种免疫反应是由内体中的HIV破坏引起的。它可能是开发“激活并杀死(shock-and-kill)”潜伏性HIV病毒的关键。
这些研究人员发现,当内体中的HIV遭受破坏时,它的一些遗传物质会暴露于T细胞,进而激活一种称为TLR8的分子。这导致细胞因子产生,从而导致体内炎症。
TLR8是身体先天免疫系统的一部分。T细胞是适应性免疫系统的一部分。通常而言,人们认为这两种系统是两个不同的独立分支。在这项新的研究中,这些研究人员发现一种与先天系统有关的受体实际上在适应性免疫系统中存在并起作用。
这篇突破性论文为逆转HIV潜伏机制带来了新见解,而且这些对TLR8作为T细胞中针对HIV的一种重要受体的发现显然代表了一种治疗HIV的潜在新靶点。此外,这些发现也可能代表着疫苗开发取得了重大进展,这是因为TLR8配体可能用作疫苗佐剂,因而可塑造HIV疫苗诱导的T细胞反应类型。
6.重磅!两篇Nature揭示逆转HIV潜伏的新策略
doi:10.1038/s41586-020-1951-3; doi:10.1038/s41586-020-1946-0
如今,在第一项新的研究中,来自美国北卡罗来纳大学教堂山分校和埃默里大学的研究人员使用一种称为AZD5582的化合物来激活血液和很多不同组织中遭受HIV潜伏感染的CD4+ T细胞,这种激活达到了令人印象深刻的水平,而且没有或几乎没有毒性。相关研究结果于2020年1月22日在线发表在Nature期刊上,论文标题为“Systemic HIV and SIV latency reversal via non-canonical NF-κB signalling in vivo”。
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
即将过去的1月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
1.Lancet HIV:新研究发现HIV“热点地区”不一定是新感染的主要驱动因素
doi:10.1016/S2352-3018(19)30378-9
在一项新的研究中,来自英国帝国理工学院等研究机构的研究人员发现称为“热点地区(hotspot)”的HIV高发地区并不一定在更广泛的人群中促进这种流行病。相关研究结果于2020年1月14日在线发表在Lancet HIV期刊上,论文标题为“Quantifying HIV transmission flow between high-prevalence hotspots and surrounding communities: a population-based study in Rakai, Uganda”。

图片来自Lancet HIV, 2020, doi:10.1016/S2352-3018(19)30378-9。
这项研究是在乌干达维多利亚湖沿岸的“热点”捕鱼社区进行的,在那里大约有40%的人群感染了HIV,是世界上HIV感染率最高的热点地区之一。这些研究人员绘制了在这些热点捕鱼社区与HIV感染率低得多的更大内陆社区之间如何传播疾病的图谱。与预期相反的是,他们发现更多的HIV感染是由HIV感染率较低的内陆社区而不是HIV热点地区造成的。
论文第一作者、帝国理工大学数学系研究员Oliver Ratmann博士说,“我们的发现表明HIV疾病(即艾滋病)动态变化并不像看起来的那样明显,并建议不要将热点地区等同于导致HIV在非洲传播的人群,也不要给它们贴上污名。”
但是,这些研究人员也提醒道这只是一个案例研究,针对其他地区的类似研究可能会揭示不同的模式。他们目前正在维多利亚湖岸更北的地方重复这项研究,以测试这些发现的可靠性。
2.Nature:科学家们探究终结全球HIV流行病的策略
doi:10.1038/s41586-019-1841-8
随着新的传染病在世界范围内不断涌现,研究人员并未忘记已存在很多年的敌人,并加倍努力来消灭它们。对于HIV病毒及其导致的免疫免疫缺陷综合征(AIDS)而言,他们已经开始寻找治愈方法。
南非夸祖鲁纳塔尔大学的Thumbi Ndung’u、比尔和梅琳达•盖茨基金会的Joseph M. McCune和美国加州大学旧金山分校的Steven G. Deeks近期在Nature期刊上发表了一篇标题为“Why and where an HIV cure is needed and how it might be achieved”的文章,评估了可能根除HIV的药物管线(pharmaceutical pipeline)中潜在的候选药物。他们的目的很简单:强调为什么需要治愈,哪里需要治愈,以及这一点可能如何实现。
这三名研究人员的一个重要结论是,许多HIV治愈研究正在HIV/AIDS患者在人口统计中不占主导地位的国家中开展。Deeks写道,“治愈研究仍然集中在HIV负担低、资源丰富的国家的学术医学中心。”他、Ndung’u和McCune认为最前沿的创新必须考虑到最需要它的人的需求和经济状况。
3.Nature子刊:新研究有助抵抗HIV和HBV
doi:10.1038/s42003-019-0706-x
在美国有100多万HIV感染者。在一项新的研究中,来自美国佛罗里达州立大学医学院的研究人员首次确定了两种广泛使用的抗病毒药物如何抑制病毒的机制。这一发现有望为世界上感染了HIV的3600多万人和其他遭受乙肝病毒(HBV)慢性感染的人打开了新的更有效的治疗选择之门。相关研究结果近期发表在Communications Biology期刊上,论文标题为“Elucidating molecular interactions of L-nucleotides with HIV-1 reverse transcriptase and mechanism of M184V-caused drug resistance”。
在这篇论文中,论文通讯作者、佛罗里达州立大学医学院的Zucai Suo教授及其同事们还提供了理解单个HIV-1突变如何可以让抗HIV药物恩曲他滨(emtricitabine)和拉米夫定(lamivudine)失去疗效的关键。这些药物为制造出它们的公司每年赢取了数十亿美元的销售额,然而产生耐药性的患者的比例为治疗这种疾病带来严重而危险的障碍。
这篇论文解释了一类称为L-核苷类逆转录酶抑制剂(L-nucleoside reverse transcriptase inhibitor, L-NRTI)的HIV药物是如何发挥作用的。L-NRTI阻断了HIV复制时需要的一种酶,不过它们是通过盲法临床试验发现的。关于L-NRTI作用机制的重要细节仍然是一个谜,也是研究它们的科学家们之间的争论焦点。
这篇论文还解释了在某些患者人群中发现的突变如何导致对抗病毒药物L-NRTI产生耐药性。Suo说,“患者、HIV科学家和医生都将受益于L-NRTI。HIV科学家和制药公司如今将知道它们的作用机制,并将能够利用这类药物设计出更好的药物。他们将能够在这篇论文描述的机制上进行轻微的调整,以获得更好和更强大的治疗选择。”
4.MMWR:在暴露于HIV的妊娠中,神经管缺陷的患病率为7.0/10000
doi:10.15585/mmwr.mm6901a1
在一项新的研究中,来自美国疾病预防控制中心(CDC)的Jennita Reefhuis博士及其同事们报道在暴露于HIV的妊娠中,每10000例活产中有7.0例神经管缺陷(neural tube defect),这种患病率与一般人群的患病率相似。相关研究结果发表在2020年1月10日的Morbidity and Mortality Weekly Report期刊上,论文标题为“Neural Tube Defects in Pregnancies Among Women With Diagnosed HIV Infection — 15 Jurisdictions, 2013–2017”。

图片来自CC0 Public Domain。
这些研究人员使用了两个CDC HIV/AIDS监测计划的相关数据,估算了美国的15个司法管辖区在2013年至2017年期间的神经管缺陷总体患病率、在暴露于HIV的妊娠中的神经管缺陷患病率以及出生缺陷。
这些研究人员发现,在诊断出遭受HIV感染的女性中,神经管缺陷的患病率为每10000例活产中有7.0例。这种神经管缺陷患病率与这15个司法管辖区的一般人群的患病率相似(每10000例活产中有7.0例),而且也与美国根据24个州的数据估算的患病率(每10000例活产中大约有8例)相似。
5.Nat Commun:新研究揭示免疫系统检测和应对HIV感染新机制
doi:10.1038/s41467-019-13837-4
在一项新的研究中,来自挪威科技大学、奥斯陆大学和中国清华大学的研究人员发现了免疫系统以一种以前未知的方式检测和应对HIV感染,这可能提高治愈这种疾病的机会。相关研究结果近期发表在Nature Communications期刊上,论文标题为“Sensing of HIV-1 by TLR8 activates human T cells and reverses latency”。
当HIV进入体内时,它会感染免疫系统用来抵抗它的免疫细胞,即CD4 辅助性T细胞(CD4 T细胞)。一旦这些T细胞遭受感染,它们就无法保护身体免受其他疾病或感染。因此,由HIV感染引起的疾病称为获得性免疫缺陷综合征(AIDS)。
当辅助性T细胞没有与HIV病毒上的配体相匹配的受体时,它就不能主动感染这种T细胞。相反,这种病毒可以被捕获在细胞中称为内体(endosome)的囊泡内。过去,科学家们认为,这种特定的途径---HIV被捕获在辅助性T细胞的内体中,而辅助性T细胞破坏了内体中的内含物---是HIV感染的死胡同。毕竟,辅助性T细胞实际上没有受到感染,并且它们的内体破坏了这种病毒。但是如今,这些研究人员发现了先前未描述的免疫反应,这种免疫反应是由内体中的HIV破坏引起的。它可能是开发“激活并杀死(shock-and-kill)”潜伏性HIV病毒的关键。
这些研究人员发现,当内体中的HIV遭受破坏时,它的一些遗传物质会暴露于T细胞,进而激活一种称为TLR8的分子。这导致细胞因子产生,从而导致体内炎症。
TLR8是身体先天免疫系统的一部分。T细胞是适应性免疫系统的一部分。通常而言,人们认为这两种系统是两个不同的独立分支。在这项新的研究中,这些研究人员发现一种与先天系统有关的受体实际上在适应性免疫系统中存在并起作用。
这篇突破性论文为逆转HIV潜伏机制带来了新见解,而且这些对TLR8作为T细胞中针对HIV的一种重要受体的发现显然代表了一种治疗HIV的潜在新靶点。此外,这些发现也可能代表着疫苗开发取得了重大进展,这是因为TLR8配体可能用作疫苗佐剂,因而可塑造HIV疫苗诱导的T细胞反应类型。
6.重磅!两篇Nature揭示逆转HIV潜伏的新策略
doi:10.1038/s41586-020-1951-3; doi:10.1038/s41586-020-1946-0
如今,在第一项新的研究中,来自美国北卡罗来纳大学教堂山分校和埃默里大学的研究人员使用一种称为AZD5582的化合物来激活血液和很多不同组织中遭受HIV潜伏感染的CD4+ T细胞,这种激活达到了令人印象深刻的水平,而且没有或几乎没有毒性。相关研究结果于2020年1月22日在线发表在Nature期刊上,论文标题为“Systemic HIV and SIV latency reversal via non-canonical NF-κB signalling in vivo”。

当遭受HIV潜伏感染的免疫细胞受到重新激活时,这种细胞开始产生HIV病毒颗粒(红色),这些病毒颗粒出芽并从细胞(蓝色)中释放出来,图片来自NIAID。
这项开创性的研究是由北卡罗来纳大学教堂山分校医学院的研究人员在具有功能完整的人类免疫细胞的小鼠模型中完成的,这些免疫细胞遭受HIV感染,并通过ART药物加以抑制。重要的是,这项研究随后在埃默里大学的一项纵向多剂量实验中得到了扩展。这项纵向多剂量实验以感染了猿猴免疫缺陷病毒(SIV)并可通过ART药物加以抑制的恒河猴为研究对象。Qura Therapeutics公司与北卡罗来纳大学教堂山分校和ViiV Healthcare公司合作,开展了基础科学研究,从而加快了动物模型中的研究工作。在人体中开始测试之前,还需开展更多的研究,但是这项研究被认为是迈向开发治愈性疗法的重要科学步骤。
这些研究人员随后在全身组织含有可被HIV感染且可通过ART药物加以抑制的人CD4+ T细胞的小鼠模型中测试了AZD5582。他们记录了在血液和几乎所有组织(包括淋巴结、胸腺、骨髓、肝脏、肺部和大脑)中表达的HIV病毒RNA增加了。在某些情况下,HIV病毒RNA增加了20倍以上。
他们还在遭受SIV感染且可通过ART加以抑制的恒河猴中测试了AZD5582,给它们提供多剂量的AZD5582而且是每周提供一剂量,随后发现了类似的结果。他们观察到这些恒河猴的淋巴结和血液中的SIV RNA表达激增,这标志着一种潜伏逆转剂首次在两种动物模型中完成了这一壮举,而且几乎没有毒性。
在第二项新的研究中,Guido Silvestri博士和Chahroudi领导的埃默里大学研究人员与北卡罗来纳大学教堂山分校的研究人员合作,以一种不同的方式实现了潜伏逆转。相关研究结果于2020年1月22日在线发表在Nature期刊上,论文标题为“Robust and persistent reactivation of SIV and HIV by N-803 and depletion of CD8+ cells”。
他们将一种抗体注射到感染HIV并通过ART加以抑制的非人灵长类动物中来清除在控制病毒感染中起着非常重要作用的CD8+ T细胞。他们随后给送细胞因子IL-15的一种改进版本,结果发现这种组合用药让SIV RNA出现在之前未观察到的血液和组织中。针对HIV,他们在进行过AZD5582测试的相同小鼠模型中发现类似的结果。
7.J Infect Dis:尽管接受抗逆转录病毒治疗,HIV患者仍然丧失了对天花的免疫力
doi:10.1093/infdis/jiz678
在一项新的研究中,来自美国俄勒冈健康与科学大学和俄勒冈国家灵长类研究中心的研究人员报道HIV患者尽管在童年时接种了天花疫苗,而且抗逆转录病毒药物(ART)治疗也让他们的免疫系统恢复了很多,但是他们还是对天花病毒丧失了免疫力。相关研究结果近期发表在Journal of Infectious Diseases期刊上,论文标题为“Loss of Preexisting Immunological Memory Among Human Immunodeficiency Virus–Infected Women Despite Immune Reconstitution With Antiretroviral Therapy”。
论文通讯作者、俄勒冈健康与科学大学分子微生物学与免疫学教授Mark K. Slifka博士和他的同事们比较了总计100例年轻时接种过天花疫苗的HIV阳性女性和HIV阴性女性的T细胞反应和抗体反应。
Slifka及其研究团队之所以选择天花,是因为它在美国的最后一个病例出现在1949年,这意味着这些研究受试者近期并未暴露于天花病毒,不然,这种病毒会触发新的T细胞反应和抗体反应。 Slifka团队发现,接受ART治疗的HIV阳性女性的免疫系统在她们的血液暴露于天花疫苗中使用的牛痘病毒时产生有限的反应。在正常情形下,那些接种了天花疫苗的人具有的CD4 T细胞会记住天花病毒,而且当再次暴露于这种病毒时,会大量地作出反应。先前的研究已表明天花病毒特异性的CD4 T细胞在接种天花疫苗后可维持长达75年的时间。
8.Nat Commun:单一剂量的抗体疗法或有望阻断新生儿HIV的感染和复制
doi:10.1038/s41467-019-13972-y
近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自俄勒冈健康与科学大学的科学家们通过对新生非人类灵长类动物进行研究后首次发现,单剂量基于抗体的疗法或能有效抑制HIV从母亲传播给婴儿。
然而,何时给予单一剂量是关键,研究发现,当接触SHIV(猴类HIV)30小时后,接受两种抗体组合疗法就会让新出生的猕猴不会感染该病毒;如果将治疗推迟到48小时,就会导致另一半新生猕猴感染SHIV,因为其接受了最小剂量的抗体组合性疗法;相比之下,当暴露后48小时开始为期三周的治疗方案,接受标准HIV疗法(抗逆转录病毒药物)的新生猕猴会免于SHIV的感染。研究者Nancy Haigwood教授说道,这些有希望的研究发现可能意味着,HIV阳性母亲所生育的婴儿即使接受较少的治疗仍然也能有效抵御HIV的感染。
9.Cell:新型工具有望加速抗体识别和疫苗开发研究 或能使HIV等多种疾病获益
doi:10.1016/j.cell.2019.11.003
近日,一项刊登在国际杂志Cell上的研究报告中,来自范德堡大学的科学家们通过研究开发了一种新工具或有望加速抗体疫苗的研究;这种名为“LIBRA-seq”的工具或有望让抗体发现和疫苗开发研究领域迅速扩大。
目前,由于技术限制,研究人员可能会花费一年时间从B细胞所产生的数以亿计的抗体中识别出一种单一的抗体,随后将其开发成为一种药物来识别并攻击特殊病原体上的抗原标志物;因此,研究者Ian Setliff及其同事就想知道是否能够以一种高通量的方式对抗体序列和抗原特异性同时进行绘图。
研究者Georgiev表示,这听起来似乎是一个疯狂的想法,而且很有可能是行不通的,但如今研究者实现了,他们在短短几周时间内疚能够发现一种抵御HIV的新型抗体。LIBRA-seq工具的开发和确认或能通过测序的方法将B细胞受体抗原特异性联系起来。研究者表示,通常情况下我们很难知道抗体序列,而且也并不知道针对抗体的抗原特异性是什么。
10.J Med Chem:HIV药物依法韦仑或有望治疗阿尔兹海默病
doi:10.1021/acs.jmedchem.9b01383
近日,一项刊登在国际杂志Journal of Medicinal Chemistry上的研究报告中,来自范德堡大学等机构的科学家们通过研究发现,一种用来治疗和预防HIV/AIDS的药物或有望帮助治疗阿尔兹海默病,相关研究或有望帮助开发新型疗法来改善阿尔兹海默病患者的大脑记忆和认知功能。
研究人员表示,对抗AIDS药物依法韦仑(EFV,efavirenz)进行结构修饰或能增加其激活特殊酶类的能力,而这种酶类能够帮助从大脑中移除胆固醇;胆固醇被认为会诱发β淀粉样蛋白斑块的聚集,而其聚集是阿尔兹海默病发病的主要标志,20世纪90年代末期,酶类P450 46A1 (CYP46A1)被发现对于分解并消除大脑中的胆固醇非常重要。
在过去35年多的时间里,研究人员通过深入研究理解了P450酶对药物、致癌物和包括胆固醇在内的其它生物性分子代谢的机制。5年前,研究者Guengerich及同事通过研究发现,EFV或能通过结合到CYP46A1酶的变构部位来激活该酶类,该位点与胆固醇的结合位点并不相同。
然而,在高剂量下,EFV能够结合变构部位和活性位点,这就能够抑制该酶类的功能,因为其无法紧紧抓住胆固醇了;这项研究中,研究人员通过进行结构功能研究发现,EFV的代谢产物或能增加CYP46A1的激活水平,同时在高浓度下还并不会抑制该酶类的而功能;EFV代谢产物来源于药物在机体中代谢所产生的化合物。后期研究人员还将继续深入研究揭示这种HIV药物有效治疗阿尔兹海默病的分子机制。(生物谷 Bioon.com)
这项开创性的研究是由北卡罗来纳大学教堂山分校医学院的研究人员在具有功能完整的人类免疫细胞的小鼠模型中完成的,这些免疫细胞遭受HIV感染,并通过ART药物加以抑制。重要的是,这项研究随后在埃默里大学的一项纵向多剂量实验中得到了扩展。这项纵向多剂量实验以感染了猿猴免疫缺陷病毒(SIV)并可通过ART药物加以抑制的恒河猴为研究对象。Qura Therapeutics公司与北卡罗来纳大学教堂山分校和ViiV Healthcare公司合作,开展了基础科学研究,从而加快了动物模型中的研究工作。在人体中开始测试之前,还需开展更多的研究,但是这项研究被认为是迈向开发治愈性疗法的重要科学步骤。
这些研究人员随后在全身组织含有可被HIV感染且可通过ART药物加以抑制的人CD4+ T细胞的小鼠模型中测试了AZD5582。他们记录了在血液和几乎所有组织(包括淋巴结、胸腺、骨髓、肝脏、肺部和大脑)中表达的HIV病毒RNA增加了。在某些情况下,HIV病毒RNA增加了20倍以上。
他们还在遭受SIV感染且可通过ART加以抑制的恒河猴中测试了AZD5582,给它们提供多剂量的AZD5582而且是每周提供一剂量,随后发现了类似的结果。他们观察到这些恒河猴的淋巴结和血液中的SIV RNA表达激增,这标志着一种潜伏逆转剂首次在两种动物模型中完成了这一壮举,而且几乎没有毒性。
在第二项新的研究中,Guido Silvestri博士和Chahroudi领导的埃默里大学研究人员与北卡罗来纳大学教堂山分校的研究人员合作,以一种不同的方式实现了潜伏逆转。相关研究结果于2020年1月22日在线发表在Nature期刊上,论文标题为“Robust and persistent reactivation of SIV and HIV by N-803 and depletion of CD8+ cells”。
他们将一种抗体注射到感染HIV并通过ART加以抑制的非人灵长类动物中来清除在控制病毒感染中起着非常重要作用的CD8+ T细胞。他们随后给送细胞因子IL-15的一种改进版本,结果发现这种组合用药让SIV RNA出现在之前未观察到的血液和组织中。针对HIV,他们在进行过AZD5582测试的相同小鼠模型中发现类似的结果。
7.J Infect Dis:尽管接受抗逆转录病毒治疗,HIV患者仍然丧失了对天花的免疫力
doi:10.1093/infdis/jiz678
在一项新的研究中,来自美国俄勒冈健康与科学大学和俄勒冈国家灵长类研究中心的研究人员报道HIV患者尽管在童年时接种了天花疫苗,而且抗逆转录病毒药物(ART)治疗也让他们的免疫系统恢复了很多,但是他们还是对天花病毒丧失了免疫力。相关研究结果近期发表在Journal of Infectious Diseases期刊上,论文标题为“Loss of Preexisting Immunological Memory Among Human Immunodeficiency Virus–Infected Women Despite Immune Reconstitution With Antiretroviral Therapy”。

HIV-1病毒,图片来自 J Roberto Trujillo/Wikipedia。
论文通讯作者、俄勒冈健康与科学大学分子微生物学与免疫学教授Mark K. Slifka博士和他的同事们比较了总计100例年轻时接种过天花疫苗的HIV阳性女性和HIV阴性女性的T细胞反应和抗体反应。
Slifka及其研究团队之所以选择天花,是因为它在美国的最后一个病例出现在1949年,这意味着这些研究受试者近期并未暴露于天花病毒,不然,这种病毒会触发新的T细胞反应和抗体反应。 Slifka团队发现,接受ART治疗的HIV阳性女性的免疫系统在她们的血液暴露于天花疫苗中使用的牛痘病毒时产生有限的反应。在正常情形下,那些接种了天花疫苗的人具有的CD4 T细胞会记住天花病毒,而且当再次暴露于这种病毒时,会大量地作出反应。先前的研究已表明天花病毒特异性的CD4 T细胞在接种天花疫苗后可维持长达75年的时间。
8.Nat Commun:单一剂量的抗体疗法或有望阻断新生儿HIV的感染和复制
doi:10.1038/s41467-019-13972-y
近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自俄勒冈健康与科学大学的科学家们通过对新生非人类灵长类动物进行研究后首次发现,单剂量基于抗体的疗法或能有效抑制HIV从母亲传播给婴儿。
然而,何时给予单一剂量是关键,研究发现,当接触SHIV(猴类HIV)30小时后,接受两种抗体组合疗法就会让新出生的猕猴不会感染该病毒;如果将治疗推迟到48小时,就会导致另一半新生猕猴感染SHIV,因为其接受了最小剂量的抗体组合性疗法;相比之下,当暴露后48小时开始为期三周的治疗方案,接受标准HIV疗法(抗逆转录病毒药物)的新生猕猴会免于SHIV的感染。研究者Nancy Haigwood教授说道,这些有希望的研究发现可能意味着,HIV阳性母亲所生育的婴儿即使接受较少的治疗仍然也能有效抵御HIV的感染。
9.Cell:新型工具有望加速抗体识别和疫苗开发研究 或能使HIV等多种疾病获益
doi:10.1016/j.cell.2019.11.003
近日,一项刊登在国际杂志Cell上的研究报告中,来自范德堡大学的科学家们通过研究开发了一种新工具或有望加速抗体疫苗的研究;这种名为“LIBRA-seq”的工具或有望让抗体发现和疫苗开发研究领域迅速扩大。
目前,由于技术限制,研究人员可能会花费一年时间从B细胞所产生的数以亿计的抗体中识别出一种单一的抗体,随后将其开发成为一种药物来识别并攻击特殊病原体上的抗原标志物;因此,研究者Ian Setliff及其同事就想知道是否能够以一种高通量的方式对抗体序列和抗原特异性同时进行绘图。
研究者Georgiev表示,这听起来似乎是一个疯狂的想法,而且很有可能是行不通的,但如今研究者实现了,他们在短短几周时间内疚能够发现一种抵御HIV的新型抗体。LIBRA-seq工具的开发和确认或能通过测序的方法将B细胞受体抗原特异性联系起来。研究者表示,通常情况下我们很难知道抗体序列,而且也并不知道针对抗体的抗原特异性是什么。
10.J Med Chem:HIV药物依法韦仑或有望治疗阿尔兹海默病
doi:10.1021/acs.jmedchem.9b01383
近日,一项刊登在国际杂志Journal of Medicinal Chemistry上的研究报告中,来自范德堡大学等机构的科学家们通过研究发现,一种用来治疗和预防HIV/AIDS的药物或有望帮助治疗阿尔兹海默病,相关研究或有望帮助开发新型疗法来改善阿尔兹海默病患者的大脑记忆和认知功能。
研究人员表示,对抗AIDS药物依法韦仑(EFV,efavirenz)进行结构修饰或能增加其激活特殊酶类的能力,而这种酶类能够帮助从大脑中移除胆固醇;胆固醇被认为会诱发β淀粉样蛋白斑块的聚集,而其聚集是阿尔兹海默病发病的主要标志,20世纪90年代末期,酶类P450 46A1 (CYP46A1)被发现对于分解并消除大脑中的胆固醇非常重要。
在过去35年多的时间里,研究人员通过深入研究理解了P450酶对药物、致癌物和包括胆固醇在内的其它生物性分子代谢的机制。5年前,研究者Guengerich及同事通过研究发现,EFV或能通过结合到CYP46A1酶的变构部位来激活该酶类,该位点与胆固醇的结合位点并不相同。
然而,在高剂量下,EFV能够结合变构部位和活性位点,这就能够抑制该酶类的功能,因为其无法紧紧抓住胆固醇了;这项研究中,研究人员通过进行结构功能研究发现,EFV的代谢产物或能增加CYP46A1的激活水平,同时在高浓度下还并不会抑制该酶类的而功能;EFV代谢产物来源于药物在机体中代谢所产生的化合物。后期研究人员还将继续深入研究揭示这种HIV药物有效治疗阿尔兹海默病的分子机制。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


