揭示细胞身份被重编程的奥秘!
来源:本站原创 2019-10-20 22:43
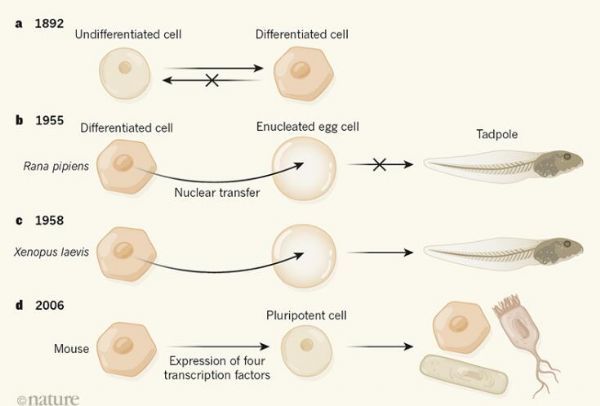
2019年10月20日 讯 /生物谷BIOON/ --有机体的所有细胞都起源于一个单细胞,随着发育不断进行,细胞就会变得越来越专门化,从而发挥特定的功能,这种“承诺”会伴随着对这些细胞潜在命运范围的限制,19世纪后期,一种主流的观点认为,当细胞发生分化时,其会保留维持细胞类型和功能所必需的遗传信息,这就演化出了一种理论,即分化是一个不可逆的过程(图1a),研究者John Gurdon等人在Natu
2019年10月20日 讯 /生物谷BIOON/ --有机体的所有细胞都起源于一个单细胞,随着发育不断进行,细胞就会变得越来越专门化,从而发挥特定的功能,这种“承诺”会伴随着对这些细胞潜在命运范围的限制,19世纪后期,一种主流的观点认为,当细胞发生分化时,其会保留维持细胞类型和功能所必需的遗传信息,这就演化出了一种理论,即分化是一个不可逆的过程(图1a),研究者John Gurdon等人在Nature杂志上发表文章重点关注了细胞身份的核编程过程,这就提出了一种挑战,并为今天细胞重编程领域奠定了基础。
图片来源:Nature,doi:10.1038/d41586-019-02834-8.
Gurdon在1958年发表的文章是以研究者Robert Briggs和Thomas King的研究为先导的,为了研究分化细胞的发育潜力,研究者Briggs等人使用了一种名为核转移的技术,即将细胞核从一个细胞中移除,随后将另一个细胞中完整的细胞核移入该细胞,这项实验是一项此前只在单细胞生物体中完成的技术壮举。
随后研究者在更复杂的北美豹蛙(Rana pipiens)机体中使用了这种方法,他们能通过卵裂球的细胞核来代替卵细胞的细胞核,从而培育出了正常游动的蝌蚪,这些细胞是通过受精卵细胞在早期分裂而形成的;然而,在更高级的分化阶段,来自北美豹蛙的核转移或许并不能够支持正常青蛙的发育(图1b)。
研究结果表明,卵裂球的细胞核在分化过程中并不会进行不可逆的改变,随着发育进行,所移植的细胞支持正常发育的潜力会降低,这就表明,细胞分化可能是不可逆的,而且其会牵扯多个不可逆的遗传改变,因此研究者得出结论,晚期原肠胚的细胞核在分化潜能上或许存在内在的限制。1958年,研究者Elsdale等人利用非洲爪蛙解决了围绕分化细胞潜能的问题,与受季节限制的林蛙不同,非洲爪蛙一年四季都有,而且很快会进入性成熟阶段,研究者发现,来自不同发育阶段的细胞供体细胞核能被转移到非洲爪蛙的卵细胞中(从早期的卵裂球到孵化前的蝌蚪细胞)。
供体的细胞核来源于一个突变体,其中每个细胞都含有一个细胞核核仁,而不是通常的两个;这种方法能提供一种视觉标记来帮助证实从细胞和转移中获得的动物确实来自于转移的细胞核,而不是卵子中现存的物质。相关研究表明,这些正常的蝌蚪能从发育到孵化前阶段的细胞中获得,而这远远晚于研究者所使用的细胞所处的发育阶段。
许多从含有转移细胞核的细胞发育而来的蝌蚪都经历了正常的蜕变成为了青蛙,这似乎是性成熟的表现,研究者注意到,从分化最多的细胞核衍生出的青蛙在蜕变前不久就会意外死亡,而随后的报告并未出现这种状况。研究者认为,分化的细胞核能够促进发育成功,尽管存在不一致性,研究人员认为,细胞核在分化过程中支持正常发育的能力会有所下降,而且一些分化的细胞核还能够支持正常发育。分化细胞的状态并不是不可逆基因组变化的结果,相反,分化细胞的细胞核能够保留一种能力来协调完整功能有机体的发育。
在对两栖类动物进行研究40年后,一个来自成年乳腺上皮细胞的细胞核移植被用来制造一个克隆的哺乳动物—绵羊多莉,同时研究者还报道了一只利用成体细胞进行核移植技术所产生的克隆鼠—卡姆莉娜。20世纪80年代,早期的重编程研究结果表明,研究者不仅能够将细胞身份重置为早期胚胎发育的空白状态,还能够完全转变细胞的身份,比如,一项研究就表明,小鼠的肌肉细胞能与人类羊膜细胞相融合,从而产生产生携带人类和小鼠细胞核的细胞,最终会促进人类肌肉特异性基因出现快速表达。
一个关键的时刻出现在1987年,当时研究人员鉴别出了能重编程细胞身份的单一因素,即一种称之为MyoD (一种转录因子)的表达,其被证明能将成纤维细胞转化成为收缩的肌肉细胞。研究者Gurdon及其同事通过研究阐明,在分化的细胞中能够恢复细胞的发育潜能,而细胞生物学家如今已经开发出了多种技术来对细胞身份进行重编程操作;比如研究者能利用转录因子介导的重编程过程来将细胞返回至胚胎状态,随后通过模拟正常的发育过程来使其分化为想要的细胞身份;此外,通过表达一种特殊因子将一种分化的细胞类型转化为另一种细胞类型,就能完全避免胚胎状态,诸如此类策略或许就能提供相应的策略来帮助制造源于患者机体的细胞来模拟疾病的发病过程。
此外,细胞重编程也是各种再生疗法开发的基础,包括在眼睛后方视网膜上产生细胞来治疗老年性黄斑变性疾病等。研究者Gurdon及其同事在20世纪50年代得出的研究结果就认为,发育时钟能被重置的结论挑战了一种长期存在的观点,即细胞分化是一种不可逆的过程,如今他们的研究工作为当前开发新型重编程技术奠定了基础,也为开发治疗一系列人类疾病的新型疗法提供了新的思路和希望。(生物谷Bioon.com)
参考资料:
【1】Sexually mature individuals of Xenopus laevis from the transplantation of single somatic nuclei.
【2】Transplantation of Living Nuclei From Blastula Cells into Enucleated Frogs' Eggs.
【3】The current status of cloning and nuclear reprograming in amphibian eggs.
【4】CHANGES IN THE NUCLEI OF DIFFERENTIATING GASTRULA CELLS, AS DEMONSTRATED BY NUCLEAR TRANSPLANTATION.
【5】Campbell KH, McWhir J, Ritchie WA, et al. Sheep cloned by nuclear transfer from a cultured cell line. Nature. 1996 Mar 7;380(6569):64-6.
【6】Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei.
【7】Hochedlinger K, Jaenisch R. Monoclonal mice generated by nuclear transfer from mature B and T donor cells. Nature. 2002 Feb 28;415(6875):1035-8. Epub 2002 Feb 10.
【8】Expression of a single transfected cDNA converts fibroblasts to myoblasts.
【9】From nuclear transfer to nuclear reprogramming: the reversal of cell differentiation.
【10】Cohen DE, Melton D. Turning straw into gold: directing cell fate for regenerative medicine. Nat Rev Genet. 2011 Apr;12(4):243-52. doi: 10.1038/nrg2938. Epub 2011 Mar 9.
【11】Morris SA, Daley GQ. A blueprint for engineering cell fate: current technologies to reprogram cell identity. Cell Res. 2013 Jan;23(1):33-48. doi: 10.1038/cr.2013.1. Epub 2013 Jan 1.
【12】Vierbuchen T, Wernig M. Direct lineage conversions: unnatural but useful? Nat Biotechnol. 2011 Oct;29(10):892-907. doi: 10.1038/nbt.1946.
【13】Passier R, Orlova V, Mummery C. Complex Tissue and Disease Modeling using hiPSCs. Cell Stem Cell. 2016 Mar 3;18(3):309-21. doi: 10.1016/j.stem.2016.02.011.
【14】Mandai M, Watanabe A, Kurimoto Y, et al. Autologous Induced Stem-Cell-Derived Retinal Cells for Macular Degeneration. N Engl J Med. 2017 Mar 16;376(11):1038-1046. doi: 10.1056/NEJMoa1608368.
【15】Samantha A. Morris. Cell identity reprogrammed, Nature (2019) doi:10.1038/d41586-019-02834-8
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。