Cell Stem Cell:揭示造血干细胞休眠新机制
来源:本站原创 2021-08-04 13:45
2021年8月4日讯/生物谷BIOON/---溶酶体是所有细胞中的有膜细胞器。溶酶体曾经被认为只是干细胞的“垃圾桶”,回收废弃物,调节细胞再生,并在所有细胞类型中发挥同样的功能。在一项新的研究中,来自加拿大玛嘉烈公主癌症中心和多伦多大学的研究人员对休眠的造血干细胞如何被激活有了更广泛的了解,这可能为开发针对一些癌症的治疗方法铺平道路。他们通过对溶酶体进行深入
2021年8月4日讯/生物谷BIOON/---溶酶体是所有细胞中的有膜细胞器。溶酶体曾经被认为只是干细胞的“垃圾桶”,回收废弃物,调节细胞再生,并在所有细胞类型中发挥同样的功能。
在一项新的研究中,来自加拿大玛嘉烈公主癌症中心和多伦多大学的研究人员对休眠的造血干细胞如何被激活有了更广泛的了解,这可能为开发针对一些癌症的治疗方法铺平道路。他们通过对溶酶体进行深入的机理研究取得了这一发现。这项新的研究建立在关于溶酶体的新知识上,显示它们作为关键的信号枢纽,调节长期造血干细胞(long-term hematopoietic stem cell, LT-HSC)。相关研究结果于2021年8月2日在线发表在Cell Stem Cell期刊上,论文标题为“TFEB-mediated endolysosomal activity controls human hematopoietic stem cell fate”。论文通讯作者为玛嘉烈公主癌症中心的John Dick博士和Stephanie Xie博士。论文第一作者为玛嘉烈公主癌症中心的Laura Garcia-Prat博士。

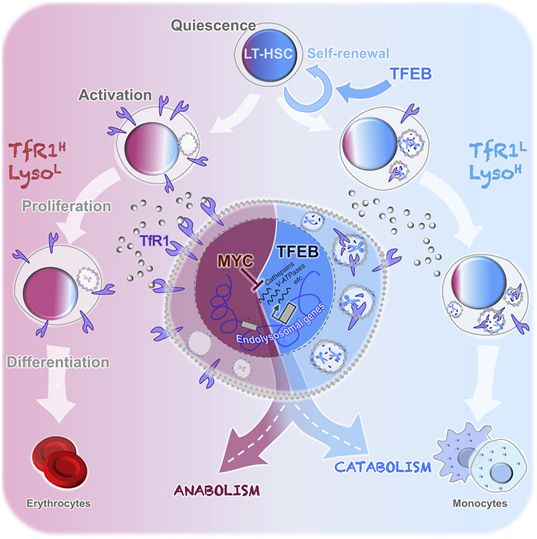
这些作者发现,溶酶体受到蛋白TFEB(transcription factor EB)和MYC的二分调节,以平衡激活LT-HSC所需的分解代谢和合成代谢过程,并指导其谱系命运TFEB介导的内溶酶体途径诱导导致膜受体降解,限制LT-HSC的代谢和有丝分裂激活,促进它们的静止和自我更新,并调控它们的红系-髓系细胞定型(erythroid-myeloid commitment)。相反,MYC参与生物合成过程,同时抑制溶酶体分解代谢,驱动LT-HSC激活。这项研究确定了TFEB介导的溶酶体活性控制是适当和协调的干细胞命运决定的中心调节中心。
这些作者探究了为什么造血干细胞可以保持多年的休眠状态,以及溶酶体如何在这种深度不活跃的状态下持续充当传感器。他们发现,尽管造血干细胞处于休眠状态,但其内部的溶酶体仍然非常活跃,“剪断和灭活”参与干细胞膜内生长信号传递和营养运输的受体,使其保持沉睡状态。
这些研究结果的意义可能超出了这项研究的范围,有可能允许控制细胞休眠和干细胞何时被激活以帮助补充血液供应之间的平衡。
Garcia-Prat博士说,“这项研究发现了一种新的休眠机制,即利用溶酶体使造血干细胞保持休眠状态。这为溶酶体作为治疗靶点开辟了一条道路。”
每年,全世界有数以万计的人接受骨髓移植以帮助对抗白血病。大剂量的化疗药物被用来杀死快速分裂的白血病细胞,但同时它也杀死了再生健康血液所需的造血干细胞。
造血干细胞移植用于再生患者的健康血液供应,但寻找匹配的供者可能具有挑战性,特别是在不同的种族社区。在脐带血中发现的造血干细胞将有相当大的价值,作为额外的捐赠来源,但造血干细胞的数量对于成年受者来说往往太少。了解如何以可控的方式激活和扩大造血干细胞,可以使脐带血的用途更加广泛。
图片来自Cell Stem Cell, 2021, doi:10.1016/j.stem.2021.07.003。
能够控制造血干细胞的激活,对于造血干细胞因疾病、炎症或药物治疗而被不适当地激活的情况也可能是有用的,比如在这些情况下,让它们恢复休眠状态以保存这些宝贵的干细胞资源。
Dick博士说,“学习如何保存和保护造血干细胞是至关重要的。如果这些干细胞以不适当的方式被激活,会对血液系统产生巨大的影响,因为你现在正在失去你的造血干细胞,你这辈子都不会再有了。你必须尽一切努力使这些干细胞保持休眠状态。而做到这一点的一种方法是防止它从表面感知任何信号。”
这项研究也可能用于帮助更全面地了解白血病干细胞,它们与正常的造血干细胞非常相似,有时能够进入休眠状态并逃避治疗。
Xie博士说,“现在看看这些白血病干细胞,看看这种机制是如何被调控的,将是很有趣的。我们可能会看到差异,并利用它们进行治疗。”
Garcia-Prat博士说,“我们是世界上少数几个使用人类造血干细胞的实验室之一。不过,在将我们的研究转化为人类的治疗方法方面,这有很大的不同。”(生物谷 Bioon.com)
参考资料:
Laura García-Prat et al. TFEB-mediated endolysosomal activity controls human hematopoietic stem cell fate. Cell Stem Cell, 2021, doi:10.1016/j.stem.2021.07.003.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


