Nature:阿尔兹海默症出现之前血脑屏障已受损!APOE4或是罪魁祸首!
来源:本站原创 2020-05-03 08:58
2020年5月3日讯 /生物谷BIOON /——阿尔兹海默病最著名的特点是丛生的错误折叠的β-淀粉样蛋白(Aβ)和Tau蛋白,它们总是出现在大脑中。然而有越来越多的研究意识到到Aβ和Tau可能不是全部--血脑屏障(BBB)的改变也成为早期神经退行性疾病的标记。脑血脑屏障的破坏程度与一个人所经历的认知功能障碍的程度有关,但究竟是什么原因导致脑血脑屏障的破坏还不
2020年5月3日讯 /生物谷BIOON /——阿尔兹海默病最著名的特点是丛生的错误折叠的β-淀粉样蛋白(Aβ)和Tau蛋白,它们总是出现在大脑中。然而有越来越多的研究意识到到Aβ和Tau可能不是全部--血脑屏障(BBB)的改变也成为早期神经退行性疾病的标记。脑血脑屏障的破坏程度与一个人所经历的认知功能障碍的程度有关,但究竟是什么原因导致脑血脑屏障的破坏还不得而知。4月29日,Montagne等人在Nature杂志上撰文指出,阿尔兹海默病的主要遗传风险因素--载脂蛋白E4与血脑屏障的破坏有关。
载脂蛋白E (APOE)基因在大脑中编码一种主要的载脂蛋白APOE。APOE主要有三种变体:APOE2、APOE3和APOE4。与几乎所有的基因一样,人们携带两种APOE拷贝,它们可能是相同的变体,也可能是不同的变体。与更常见的APOE3变体相比,APOE4可显着增加患老年痴呆症的风险--携带一种APOE4变体的人患病风险可达4倍,携带两种APOE4变体的人患病风险可达15倍。携带APOE4的阿尔兹海默病患者比那些不携带携带APOE4突变基因的阿尔兹海默病患者出现症状的时间更早。
APEO突变体与阿尔兹海默症,图片来源:Nature
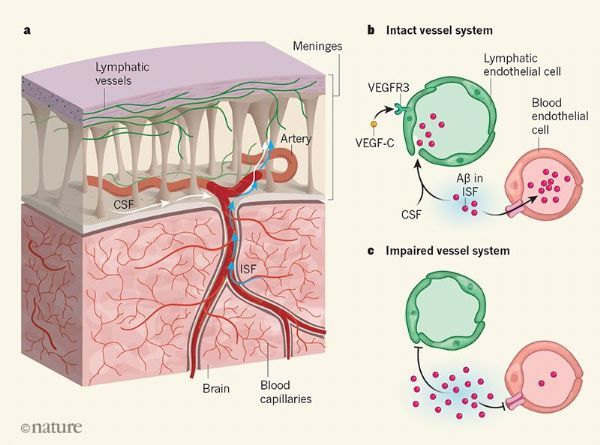
在认知健康的携带APOE4的人的脑脊液(围绕大脑和脊髓的液体)中发现了血浆中的蛋白质,这些人随后患上了阿尔兹海默病。这些蛋白质可能是通过血脑屏障泄露出来的,这表明在认知能力下降之前,血脑屏障的完整性就丧失了。从小鼠模型和死于阿尔兹海默病的人的大脑中获得的证据表明,血脑屏障的破坏是由位于大脑毛细血管壁上的周细胞的退化引起的。这些细胞通常通过阻止构成毛细血管壁的内皮细胞间连接的破坏来保护BBB。
然而研究人员到现在还不清楚ApoE4是否在阿尔兹海默症患者中导致了早期的BBB功能失调,以及是否自己完成或者与Aβ和Tau一起完成?Montagne和他的同事着手解决这一知识鸿沟。作者使用了一种称为动态对比增强磁共振成像的技术来调查那些有健康认知或轻度认知障碍(阿尔兹海默病的前奏)的人的血脑屏障的通透性,并根据他们的APOE状态进行分组。他们发现,那些认知健康、携带一份或两份APOE4拷贝的人,在对记忆和认知很重要的两个大脑区域--海马体和海马旁回--的BBB出现泄漏。在表现出轻度认知能力下降的APOE4携带者中,这种情况更为严重。
值得注意的是,这些影响早于海马和海马旁回的任何组织丢失的迹象,证明了BBB的破坏是神经退化开始的一个早期事件。作者通过脑脊液分析和正电子发射断层扫描成像发现BBB泄漏独立于Aβ和Tau积累。Montagne和他的同事发现,与APOE4携带者不同的是,认知健康的APOE3携带者的血脑屏障是完整的。然而,表现出认知障碍情况的APOE3携带者的BBB也出现有漏洞--尽管与同等阶段的APOE4携带者相比要少一些。
接下来,Montagne等人研究了APOE4携带者中BBB的分解是否与周细胞变性有关。他们发现与APOE3携带者相比,APOE4携带者的脑脊液中周皮细胞损伤的生物标志物--一种可溶性的蛋白质称为血小板源生长因子受体-β(sPDGFRβ)--升高了。携带APOE4的人体内的高蛋白水平与血脑屏障渗漏和认知障碍有关。同时,sPDGFRβ升高是独立于Aβ和τ。
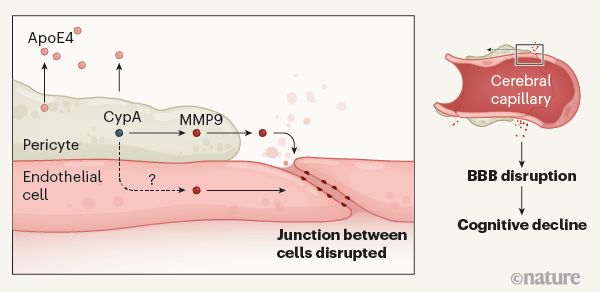
然后作者们寻找了周细胞受伤的机制。他们重点研究了嗜环蛋白A (CypA)和基质金属蛋白酶-9 (MMP9),这两种蛋白是APOE 4驱动的周细胞损伤和BBB分解的炎症通路的一部分。轻度认知障碍的APOE4携带者的脑脊液中CypA和MMP9的水平高于认知功能正常的APOE4携带者和认知功能异常的APOE3携带者。同样,这种变化与增加的Aβ或Tau无关。
最后,研究人员在体外从表达APOE3或APOE4的人类诱导多能干细胞中产生周细胞。他们发现表达APOE4的周细胞比表达APOE3的周细胞分泌更多的CypA和MMP9。周细胞分泌的ApoE4(而不是ApoE3)激活附近周细胞的CypA-MMP9通路,因此这些细胞会导致自身的死亡。ApoE4还可以激活内皮细胞中的CypA-MMP9通路,而这一通路易受APOE4的有害影响。因此,对周细胞和内皮细胞的损伤都可能导致BBB渗漏。
图片来源:Nature
这些关于APOE4的新观点有违人们普遍认为这种基因变异导致阿尔兹海默病仅仅通过促进Aβ和Tau。相反,BBB功能障碍似乎可以解释为什么APOE4携带者易患阿尔兹海默病。作者的发现也可以解释为什么APOE4携带者在中风或脑外伤后的预后比携带其他APOE变体的人更差。然而,随着阿尔兹海默病的发展,APOE4也可以减缓Aβ和Tau的清除,加剧了认知的下降。
更惊人的发现是,APOE4和APOE3携带者在认知障碍的早期驱动因素上存在差异。Montagne和他的同事的发现表明,在携带最常见APOE变体APOE3的人群中,CypA通路的激活和周细胞损伤可能与认知障碍无关。但仍不清楚造成渗漏BBB的独立于周细胞(例如,Aβ引起的内皮细胞损伤)因的素是否会导致APOE3携带者的认知障碍。在APOE2携带者中血脑屏障的作用,在目前的研究中还没有被评估,也仍然是未知的。虽然与其他APOE变体相比,APOE2与降低阿尔兹海默病的风险有关,但这不太可能是由于更有弹性的血脑屏障,因为APOE2携带者有更高的微出血风险,这表明血管脆弱。
BBB的分解是否会导致认知障碍,以及如何导致认知障碍还有待确定。它是疾病过程的原因还是结果?来自小鼠的证据表明,血液中的某些蛋白质,如纤维蛋白原,会破坏神经元之间的突触连接。但是这些蛋白质在人脑中的致病作用还没有被证实。
撇开这些问题不谈,Montagne等人拓展了我们对APOE4如何促进认知障碍的理解。他们还证明了不同的APOE状态可以通过不同的机制促进疾病。深入了解基因变异是如何影响阿尔兹海默病的,可能会被证明是治疗这种普遍的不治之症的更加个性化的方法的关键所在。(生物谷Bioon.com)
参考资料:
【2】Montagne, A., Nation, D.A., Sagare, A.P. et al. APOE4 leads to blood-brain barrier dysfunction predicting cognitive decline. Nature (2020). https://doi.org/10.1038/s41586-020-2247-3
【5】Yamazaki, Y., Zhao, N., Caulfield, T.R. et al. Apolipoprotein E and Alzheimer disease: pathobiology and targeting strategies. Nat Rev Neurol 15, 501-518 (2019). https://doi.org/10.1038/s41582-019-0228-7
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->