1月Nature杂志重磅级亮点研究解读!
来源:生物谷原创 2025-01-31 09:20
时光总是匆匆易逝,转眼间1月份即将结束,在即将过去的1月里,Nature杂志又有哪些亮点研究值得一读呢?小编对相关亮点文章进行了整理,分享给大家!
【1】睡眠中的记忆“导演”?Nature:睡眠时瞳孔的大小或能揭示记忆被处理的分子机制
doi:10.1038/s41586-024-08340-w
在我们的大脑中,最近获得的记忆就像一群新演员,在睡眠时会在海马体这个“舞台”上被重新激活。这是记忆巩固的第一步,意味着大脑正在排练这些新的记忆,以便它们能够长期保存。然而,这里存在一个问题:如何防止新记忆与旧记忆之间发生混乱?如果新记忆和旧记忆同时上演,会不会导致一场“灾难性的遗忘”,即一种记忆的巩固抹去了另一种记忆?科学家们提出了两种理论来解释这一现象。一种观点认为,通过随机交错重新激活记忆,可以巩固多个记忆,同时最大限度地减少干扰;而另一种观点则认为,睡眠的时间微观结构(即特定的亚状态)可能在促进不同类型记忆的重新激活中起到关键作用。
近日,一篇发表在国际杂志Nature上的研究报告“Sleep microstructure organizes memory replay”,揭示了瞳孔(pupil)在这个过程中扮演的关键角色。来自康乃尔大学等机构的研究人员发现,在非快速眼动睡眠(NREM, Non-Rapid Eye Movement Sleep)的亚阶段中,当瞳孔收缩时,大脑会重播并巩固新的记忆;而当瞳孔放大时,则是较早的记忆被重播和整合的时间。这种微观结构将两个睡眠亚阶段分开,确保了记忆不会互相干扰。

为了研究这一过程,研究人员设计了一项巧妙的实验。他们给一组小鼠教导了多种任务,例如在迷宫中收集水或饼干奖励。随后,这些小鼠被装上了脑电极,并在其眼前悬挂了微型间谍摄像机,以追踪瞳孔的动态变化。一天下来,当小鼠学习了一项新任务并在睡觉时,电极捕捉到其神经活动,而摄像机则记录下瞳孔的变化。
【2】Nature:为何肺部是癌症发生转移的最常见部位?天冬氨酸信号竟是罪魁祸首!
doi:10.1038/s41586-024-08335-7
在癌症的世界里,肺部似乎成了癌细胞的“度假胜地”,有超过一半(高达54%)的转移性肿瘤患者会发生肺部癌症转移。是什么让肺部对这些不速之客如此具有吸引力呢?近日,一篇发表在国际杂志Nature上题为“Aspartate signalling drives lung metastasis via alternative translation”,揭示了这一神秘现象背后的机制。
比利时鲁汶大学癌症生物学中心的研究团队通过分析侵袭性肺部转移细胞中的基因表达特性,发现了一种被称为替代翻译程序(alternative translation program)的现象。这种程序就像是细胞内部的一个特殊开关,它改变了细胞制造蛋白质的方式,从而促使癌细胞更适应肺部环境,更容易在这里生长繁殖。
研究人员注意到,在乳腺癌小鼠和人类患者的肺部中,氨基酸天冬氨酸(aspartate)的水平显著高于未患癌的小鼠和患者。天冬氨酸通常在血浆中的浓度很低,但在转移性乳腺癌小鼠的肺部却异常丰富。这提示我们,天冬氨酸可能在促进癌细胞肺部转移方面扮演着关键角色。
【3】大脑的“内部时钟”如何被化学信使调控?Nature揭秘组蛋白单胺化的新发现
doi:10.1038/s41586-024-08371-3
大脑中的“内部时钟”——昼夜节律,就像一个精密的机械表,精确地控制着我们的睡眠、清醒和其他生理活动。然而,最近发表在国际杂志Nature上的一项研究揭示了一个惊人的新机制,展示了诸如血清素(serotonin)、多巴胺(dopamine)和组胺(histamine)等单胺类神经递质(monoamine neurotransmitters)如何通过直接与组蛋白(细胞核内包装DNA的核心蛋白质)结合来调节这些节律。
这项由普渡大学等机构科学家们完成的研究,揭示了组蛋白H3上的Gln5位点的单胺化作用——即血清素化(H3Q5ser)和多巴胺化(H3Q5dop),能够改变染色质的状态,并且这一过程是由转谷氨酰胺酶2(TG2, transglutaminase 2)催化的。研究人员发现,这些修饰不仅仅是静态的标志物,而是动态变化的,可以响应外部刺激迅速调整基因表达模式,从而影响大脑的昼夜节律和行为。
以往的研究认为,组蛋白修饰是相对固定的标志物,但新的研究表明,它们实际上是高度动态的过程。例如,当血清素或组胺等单胺类物质与组蛋白结合时,它们就像是给大脑发送了一封封“即时消息”,告诉它何时该睡觉、何时该醒来。而负责传递这些消息的“邮递员”就是TG2。TG2不仅能在组蛋白上添加单胺类物质,还能擦除并交换它们,使得基因表达可以根据环境变化灵活调整。
【4】Nature:科学家成功解决BRCA2检测的不确定性 有望改善癌症患者的风险评估和治疗护理
doi:10.1038/s41586-024-08388-8
通过临床遗传测试所识别出的种系BRCA2功能缺失突变会促使机体易患多种癌症,然而,不确定意义的突变就会限制测试结果的临床应用,因此,研究人员就有必要对所有BRCA2突变体进行功能表征和临床分类,从而促进携带这些突变体个体的临床管理。
近日,一篇发表在国际杂志Nature上题为“Functional evaluation and clinical classification of BRCA2 variants”的研究报告中,来自梅奥诊所等机构的科学家们通过研究显著提高了对BRCA2基因遗传改变的理解,BRCA2基因在人类遗传性癌症风险中扮演着关键角色。文章中,研究人员完成了对BRCA2关键DNA结合结构域中所有可能性突变的全面功能评估,从而就能对该基因部分91%的不确定意义的突变(VUS,variants of uncertain significance)进行临床分类,这一发现极大改善了遗传测试的准确性,并能促进卫生保健专业技术人员对携带这些突变的人群进行更精准的风险评估和开展个体化的治疗计划。

文章中,研究人员利用CRISPR-Cas9基因编辑技术分析了近7000个BRCA2突变体所产生的功能性影响,最终识别出了能增加癌症风险和不会增加癌症风险的突变,这一新的信息或能消除VUS的许多不确定性,从而就能让科学家们在癌症筛查、预防策略和疗法策略上做出更为明智的决定。研究者Fergus Couch博士说道,这项研究在理解很多BRCA2突变在癌症易感性方面取得了重大进展;截止到目前为止,携带VUS的患者经常会担心其是否会患癌,但如今,通过对这些突变体进行分类,研究人员就能更清楚地理解癌症风险,并相应地调整癌症预防策略以及乳腺癌疗法。
【5】Nature:人类“结构域组”或有望揭示遗传性疾病发生的根本原因
doi:10.1038/s41586-024-08370-4
改变蛋白质氨基酸序列的错义突变(missense variants)会引起三分之一的人类遗传性疾病发生,而数以千万计的错义突变存在于当前的人群中,其中绝大多数具有未知的功能性后果。
近日,一篇发表在国际杂志Nature上题为“Site-saturation mutagenesis of 500 human protein domains”的研究报告中,来自巴塞罗那科技学院等机构的科学家们通过对人类蛋白质变异进行大规模研究后发现,大多数通过将一种氨基酸替换为另一种氨基酸而引起疾病的突变,或许都是通过使蛋白质不那么稳定来实现的;而不稳定蛋白质更容易发生错误折叠和降解,这就会导致其停止工作或在细胞内积累有害的数量。
这项研究或能帮助解释为何人类基因组中的微小改变(错误突变,missense mutations)会在分子水平上引起疾病发生,他们发现,蛋白质不稳定就是遗传性白内障形成的主要驱动因素,同时也会导致不同类型的神经、发育和肌肉萎缩性疾病发生。文章中,研究人员对众所周知的621种已知的致病性错义突变进行了研究,其中有五分之三(61%)的突变会导致能检测到蛋白质稳定性的下降。
于是研究人员更加密切地关注一些致病性的突变,比如β-γ晶体蛋白就是维持人眼晶状体清晰度所必需的一种蛋白家族,他们发现,72%(18个中有13个)的与白内障形成相关的突变都会破坏晶体蛋白的稳定性,从而使得蛋白更容易积累聚集并在晶状体中形成不透明的区域。研究人员还将蛋白质的不稳定性与还原体肌病(reducing body myopathy)联系一起来,还原体肌病是一种罕见的疾病,其能引起肌肉无力和消瘦以及睑缘粘连-外胚层缺陷及唇腭裂综合症(AEC综合征,ankyloblepharon-ectodermal defects-clefting syndrome),其是一种以腭裂和其它发育症状为特征的疾病。
【6】Nature:饮食、微生物和脂肪——科学家揭示一种能控制机体脂肪和胆固醇水平的新型分子通路
doi:10.1038/s41586-024-08379-9
来自肠道微生物群的代谢产物(比如胆汁酸)能广泛调节脊椎动物的生理学特性,包括机体发育、代谢、免疫反应和认知功能等,然而,宿主反应在多大程度上能平衡微生物代谢产物的生理学效应,目前研究人员并不清楚。近日,一篇发表在国际杂志Nature上题为“Host metabolism balances microbial regulation of bile acid signaling”的研究报告中,来自康奈尔大学等机构的科学家们通过进行一项新型临床前研究表明,有益的肠道菌群和机体能共同调节脂肪代谢和胆固醇的水平。
人体能与生活在肠道中的有益微生物(称之为微生物群)共同进化,从而导致相互有利的关系,并能促进机体对食物的消化并吸收宿主和肠道菌群生存所需要的营养物质;这些关系的一个核心方面就是生物活性分子的产生,这些分子能促进食物的分解并使得营养物质被宿主所吸收。这些分子中最重要的一类称之为胆汁酸(bile acids),其是由肝脏中的胆固醇所产生的,随后会被运输到肠道并在那里促进对脂肪的消化。
科学家们早就知道,肠道细菌能将胆汁酸修饰成为一种刺激FXR受体的形式,从而减少胆汁的产生,这项最新研究表明,肠道细胞所产生的一种特殊酶类能将胆汁酸转化为一种具有相反效果的形式,这种称之为胆汁酸-甲基半胱氨(BA–MCY,bile acid-methylcysteamine)的改变形式能抑制FXR促进胆汁的产生,并能帮助促进对脂肪的代谢。研究者David Artis教授说道,我们的研究表明,肠道微生物和机体之间存在着一种特殊的对话,这对于调节胆汁酸的产生至关重要;胆汁酸能帮助消化系统将脂肪分解成机体能吸收和利用的形式。
【7】Nature:揭秘雌激素受体开关或有望帮助开发新型乳腺癌疗法
doi:10.1038/s41586-024-08400-1
雌激素受体(ER,oestrogen receptor)是一种能驱动大多数乳腺癌的核激素受体(nuclear hormone receptor),其通常会通过机体内在紊乱的N末端转激活结构域内的118号丝氨酸位点的磷酸化被激活;尽管这种修饰会促使不依赖雌激素的雌激素受体功能,而且科学家们针对该区域的激酶抑制剂进行了相关临床试验,但其背后的分子机制目前研究人员并不清楚。
近日,一篇发表在国际杂志Nature上题为“The sequence–structure–function relationship of intrinsic ERα disorder”的研究报告中,来自凯斯西储大学医学院等机构的科学家们通过研究揭示了特定的蛋白区域促进乳腺癌发生背后的分子机制,文章中,研究人员重点针对雌激素受体进行了相关研究,在此前研究中,研究人员发现刺激素受体与大约70%的乳腺肿瘤发生有关。
就好像机器需要特定的控制来运作一样,诸如雌激素受体这样的蛋白也能控制细胞的生长和行为;研究者Sichun Yang教授说道,我们在雌激素受体中发现了此前未知的“分子开关”,其虽然灵活,但却能以惊人的精度协同发挥作用从而协调细胞过程。改变该蛋白的一部分就能诱发影响乳腺癌细胞生长方式的一系列连锁反应。尽管后期研究人员还需要进行更多研究利用相关研究发现来开发新型疗法,但这一发现或能为科学家们提供远远超出乳腺癌的新型工具和想法,因为类似的蛋白质区域涉及许多其它疾病。
【8】Nature:揭示肠道细菌和宿主自身通过调节胆汁酸达成动态平衡
doi:10.1038/s41586-024-08379-9
人类的肠道是一个繁忙的活动中心,数以万亿计的微生物与人体协同工作,保持人类的健康。最近的一项研究探讨了这种伙伴关系的一个有趣方面:肠道细菌如何与宿主身体协同调节胆汁酸,即一类控制消化、胆固醇水平和脂肪代谢的重要分子。博伊斯-汤普森研究所教授Frank Schroeder说,“胆汁酸在肝脏中产生,有助于消化脂肪。但现在很明显,它们不仅仅是消化辅助剂;它们还充当信号分子,调节胆固醇水平、脂肪代谢等。它们通过与一种名为FXR的受体结合来实现这一切,FXR就像交通灯一样,控制胆固醇代谢和胆汁酸产生,以避免过度积聚。”
这就是微生物发挥作用的地方:肠道细菌可以修饰胆汁酸,从而完全改变其活性。肠道细菌可以将胆汁酸转化为强烈激活FXR的形式,向身体发出信号,减缓胆汁分泌,并改变脂肪代谢的其他方面。长期以来,科学家们一直想知道身体如何对抗微生物对代谢的抑制。
在这项研究中,Schroeder和他的团队在小鼠中发现了身体用来控制微生物影响的一个聪明伎俩。他们发现,在小鼠肠道中,身体使用一种名为VNN1的酶将微生物胆汁酸进一步修饰成一个新的衍生物家族,称为BA-MCY。与肠道细菌形成的胆汁酸不同,BA-MCY充当FXR拮抗剂——本质上是关闭FXR的“开关”。这就促进胆汁的产生,而不是限制胆汁的产生。
【9】干细胞中的持久战!Nature研究揭开DNA损伤与癌症突变的神秘面纱
doi:10.1038/s41586-024-08423-8
在一项新的研究中,来自维康桑格研究所及其合作机构的研究人员发现虽然大多数已知类型的DNA损伤是由人体细胞内部的DNA修复机制修复的,但某些形式的DNA损伤会逃避修复,并可能持续多年。这意味着DNA损伤有多种机会产生有害突变,从而导致癌症。相关研究结果于2025年1月15日在线发表在Nature期刊上,论文标题为“Prolonged persistence of mutagenic DNA lesions in somatic cells”。
他们分析了来自几个个体的数百个单细胞的家谱。该团队根据细胞之间共享突变的模式拼凑出了这些家谱,表明了存在共同的祖先。他们在这些家谱中发现了意想不到的突变遗传模式,揭示了一些DNA损伤持续保持未修复。对于造血干细胞,这可能需要两到三年的时间。这一发现改变了科学家们对突变的看法,并对理解一系列癌症的形成产生了影响。
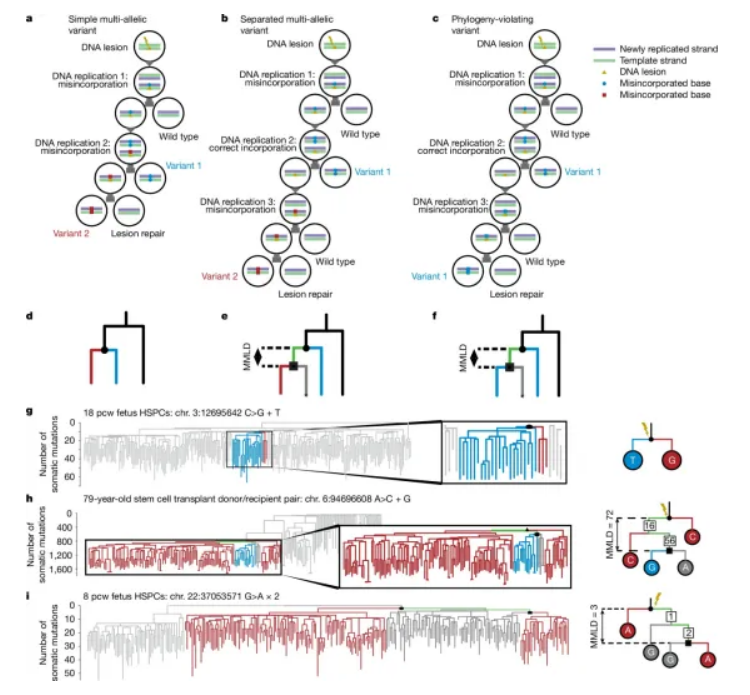
在人的一生中,人体内的所有细胞都会在基因组中积累遗传错误,即体细胞突变。这些遗传错误可能是由有害的环境暴露(比如吸烟)以及人体细胞中发生的日常化学反应引起的。DNA损伤不同于突变。虽然突变是标准四个DNA碱基(A、G、T或C)之一出现在错误位置上,类似于拼写错误,但DNA损伤是DNA的化学改变,就像一个模糊的无法识别的字母。
DNA损伤可能导致基因序列在细胞分裂过程中被误读和复制,这被称为DNA复制,这引入了可能导致癌症产生的永久性突变。然而,DNA损伤本身通常会被我们细胞中的修复机制迅速识别和修复。如果科学家们能够更好地了解突变的原因和机制,他们可能能够干预、减缓或消除突变。
【10】Nature:揭示调节身体脂肪代谢和胆固醇水平的新机制
doi:10.1038/s41586-024-08379-9
在一项新的临床前研究中,来自威尔康奈尔医学院和康奈尔大学伊萨卡校区的研究人员发现,有益的肠道微生物和身体共同作用,微调脂肪代谢和胆固醇水平。相关研究结果于2025年1月8日在线发表在Nature期刊上,论文标题为“Host metabolism balances microbial regulation of bile acid signalling”。
人体与生活在肠道中的有益微生物(称为微生物群)共同进化,形成了互惠互利的关系,有助于消化食物和吸收宿主和肠道微生物生存所需的必需营养物。这些关系的一个核心方面是产生促进食物分解的生物活性分子,使宿主能够吸收营养物。这类分子中最重要的一组被称为胆汁酸,胆汁酸由肝脏中的胆固醇产生,然后输送到肠道,在那里促进脂肪消化。科学家们早就知道,肠道细菌会将胆汁酸转化为一种刺激FXR受体的形式,从而减少胆汁的产生。这项新的研究表明,肠道细胞产生的一种酶将胆汁酸转化为另一种具有相反效果的形式。这种改变的形式称为胆汁酸甲基半胱胺(bile acid-methylcysteamine, BA-MCY),抑制FXR以促进胆汁的产生,并有助于促进脂肪代谢。
David Artis博士说,“我们的研究表明,肠道微生物和身体之间存在一种对话,这对调节胆汁酸的产生至关重要。”胆汁酸有助于消化系统将脂肪分解成身体可以吸收和使用的形式。Frank Schroeder博士说,“但现在很明显,胆汁酸不仅仅是消化促进剂;它们充当信号分子,调节胆固醇水平、脂肪代谢等。它们通过与起着交通灯作用的FXR结合来实现这一切,从而控制胆固醇代谢和胆汁酸的产生,以避免过度积聚。”(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


