治疗膀胱癌!荣昌生物ADC新药维迪西妥单抗又一新适应症获得临床试验默示许可
来源:荣昌生物制药(烟台)股份有限公司 2022-02-23 11:12
维迪西妥单抗是首款由中国公司自主研发并获批上市的ADC新药,其首个适应症于2021年6月8日获得国家药监局附条件批准上市,适用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗。同年12月31日,该药第2个适应症获批上市,用于治疗既往接受过含铂化疗且HER2过表达即免疫组化检查结果为2+或3+的局部晚期或转移性尿路
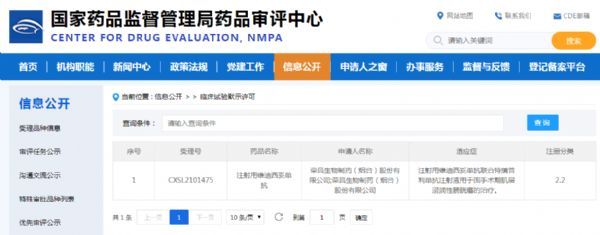
2月22日,荣昌生物制药(烟台)股份有限公司(荣昌生物-B,09995.HK)宣布:注射用维迪西妥单抗(爱地希®)联合特瑞普利单抗注射液(拓益®)治疗围手术期肌层浸润性膀胱癌(MIBC)的新药临床研究申请,获得国家药品监督管理局药品审评中心(CDE)临床试验默示许可。
维迪西妥单抗是首款由中国公司自主研发并获批上市的ADC新药,其首个适应症于2021年6月8日获得国家药监局附条件批准上市,适用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗。同年12月31日,该药第2个适应症获批上市,用于治疗既往接受过含铂化疗且HER2过表达即免疫组化检查结果为2+或3+的局部晚期或转移性尿路上皮癌患者,成为国内首个靶向 HER2 治疗尿路上皮癌的 ADC 药物。
膀胱癌作为起源于膀胱尿路上皮的恶性肿瘤,是泌尿系统最常见的恶性肿瘤之一。按照国际抗癌联盟的分期标准,膀胱癌可分为非肌层浸润性膀胱癌和肌层浸润性膀胱癌,其中肌层浸润性膀胱癌(MIBC)术后近 50%的患者2年内病情发生复发或转移,预后不佳,因此围手术期的系统治疗对于改善MIBC患者预后非常重要。该领域存在巨大未被满足的临床需求。
据悉,荣昌生物此次取得临床试验默示许可的为一项单臂、开放、多中心的Ⅱ期临床研究,由北京大学肿瘤医院郭军教授担任主要研究者。基于维迪西妥单抗在局部晚期或转移性尿路上皮癌研究的数据,旨在探索该药联合特瑞普利单抗在围手术期对计划进行外科根治性手术的MIBC患者治疗的疗效和安全性。
荣昌生物是国内少数拥有全面集成ADC平台的生物制药公司之一。基于该平台,公司不断完善、优化ADC产品管线,迄今已有7款产品进入临床研究或获批上市。除靶向HER2的维迪西妥单抗外,还有靶向间皮素的RC88、靶向c-Met的RC108、靶向Claudin18.2 的RC118已进入临床Ⅰ期,RC168、RC178和RC188已进入IND准备阶段。
■关于维迪西妥单抗(爱地希®)
维迪西妥单抗是由荣昌生物自主研发的我国首个获批上市的国产ADC(抗体-偶联)新药,在治疗HER2表达的晚期胃癌、尿路上皮癌和乳腺癌等多个肿瘤的临床试验中均取得了全球领先的数据。由于临床疗效显著优于现有治疗手段,尿路上皮癌适应症获得美国FDA和中国药监局双重突破性疗法认定,乳腺癌适应症获得中国药监局突破性疗法认定。目前,胃癌、尿路上皮癌两大适应症已获批上市,乳腺癌、肺癌、胆管癌等其它适应症的Ⅱ/Ⅲ期临床研究正在推进。2021年8月,国际知名生物制药公司西雅图基因以高达26亿美元的首付款和里程碑付款、从高个位数到百分之十五以上的梯度销售提成获得维迪西妥单抗的全球(亚太地区仅含新加坡、日本)独家许可协议,交易额一度刷新中国制药企业单品种海外授权的最高纪录。
■关于荣昌生物
荣昌生物制药(烟台)股份有限公司创建于2008年,总部位于中国(山东)自由贸易试验区烟台片区——烟台经济技术开发区,在北京、上海、美国旧金山和华盛顿设有研发中心和分支机构。2020年11月9日,荣昌生物在港交所挂牌上市,募集资金总额5.9亿美元,创下当年全球最大生物技术IPO记录。
维迪西妥单抗是首款由中国公司自主研发并获批上市的ADC新药,其首个适应症于2021年6月8日获得国家药监局附条件批准上市,适用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗。同年12月31日,该药第2个适应症获批上市,用于治疗既往接受过含铂化疗且HER2过表达即免疫组化检查结果为2+或3+的局部晚期或转移性尿路上皮癌患者,成为国内首个靶向 HER2 治疗尿路上皮癌的 ADC 药物。
膀胱癌作为起源于膀胱尿路上皮的恶性肿瘤,是泌尿系统最常见的恶性肿瘤之一。按照国际抗癌联盟的分期标准,膀胱癌可分为非肌层浸润性膀胱癌和肌层浸润性膀胱癌,其中肌层浸润性膀胱癌(MIBC)术后近 50%的患者2年内病情发生复发或转移,预后不佳,因此围手术期的系统治疗对于改善MIBC患者预后非常重要。该领域存在巨大未被满足的临床需求。
据悉,荣昌生物此次取得临床试验默示许可的为一项单臂、开放、多中心的Ⅱ期临床研究,由北京大学肿瘤医院郭军教授担任主要研究者。基于维迪西妥单抗在局部晚期或转移性尿路上皮癌研究的数据,旨在探索该药联合特瑞普利单抗在围手术期对计划进行外科根治性手术的MIBC患者治疗的疗效和安全性。
荣昌生物是国内少数拥有全面集成ADC平台的生物制药公司之一。基于该平台,公司不断完善、优化ADC产品管线,迄今已有7款产品进入临床研究或获批上市。除靶向HER2的维迪西妥单抗外,还有靶向间皮素的RC88、靶向c-Met的RC108、靶向Claudin18.2 的RC118已进入临床Ⅰ期,RC168、RC178和RC188已进入IND准备阶段。
■关于维迪西妥单抗(爱地希®)
维迪西妥单抗是由荣昌生物自主研发的我国首个获批上市的国产ADC(抗体-偶联)新药,在治疗HER2表达的晚期胃癌、尿路上皮癌和乳腺癌等多个肿瘤的临床试验中均取得了全球领先的数据。由于临床疗效显著优于现有治疗手段,尿路上皮癌适应症获得美国FDA和中国药监局双重突破性疗法认定,乳腺癌适应症获得中国药监局突破性疗法认定。目前,胃癌、尿路上皮癌两大适应症已获批上市,乳腺癌、肺癌、胆管癌等其它适应症的Ⅱ/Ⅲ期临床研究正在推进。2021年8月,国际知名生物制药公司西雅图基因以高达26亿美元的首付款和里程碑付款、从高个位数到百分之十五以上的梯度销售提成获得维迪西妥单抗的全球(亚太地区仅含新加坡、日本)独家许可协议,交易额一度刷新中国制药企业单品种海外授权的最高纪录。
■关于荣昌生物
荣昌生物制药(烟台)股份有限公司创建于2008年,总部位于中国(山东)自由贸易试验区烟台片区——烟台经济技术开发区,在北京、上海、美国旧金山和华盛顿设有研发中心和分支机构。2020年11月9日,荣昌生物在港交所挂牌上市,募集资金总额5.9亿美元,创下当年全球最大生物技术IPO记录。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->