首个地图样萎缩(GA)药物!C3补体抑制剂Empaveli(pegcetacoplan)在美国进入审查!
来源:生物谷原创 2022-11-24 09:28
GA是一种不可逆的、毁灭性的疾病,会导致视力丧失,目前尚无批准的治疗方法。

图片来源:摄图网
2022年11月18日讯 /生物谷BIOON/ --Apellis制药公司近日宣布,美国食品和药物管理局(FDA)已受理该公司主动提出的对C3补体抑制剂Empaveli(pegcetacoplan,玻璃体腔注射)治疗年龄相关性黄斑变性(AMD)继发性地图样萎缩(GA)新药申请(NDA)的重大修订。更新后的《处方药付费者申报法案》(PDUFA)目标日期为2023年2月26日。FDA还重申,不打算召开咨询委员会会议讨论该申请。GA是一种不可逆的、毁灭性的疾病,会导致视力丧失。目前,尚无批准的治疗方法。
2022年7月,FDA受理了Empaveli治疗GA的新药申请(NDA)并进行优先审查,该NDA基于3项大规模临床研究的结果(3期DERBY和OAKS研究的12个月和18个月数据,2期FILLY研究的12个月数据)。结果显示,在1500多名广泛的、异质性患者群体中,每隔一个月和每月一次Empaveli治疗均有意义地减少了GA病变生长、延缓了GA疾病的进展。3项研究中,Empaveli均显示出良好的安全性。
本月早些时候,Apellis宣布,公司决定提交3期DERBY和OAKS研究的24个月疗效数据,作为NDA审查的一部分。2项研究的24个月数据显示了每隔一个月和每月一次Empaveli增加且一致的疗效,同时安全性良好。Apellis仍有望在2022年底前向欧洲药品管理局(EMA)提交Empaveli的营销授权申请(MAA),其中也将纳入24个月结果。
GA是年龄相关黄斑变性(AMD)的一种晚期病变,可导致不可逆转的失明。GA是致盲的首要原因,该病影响全球500多万人、美国100万人。目前,GA还没有批准的治疗方法。GA是一种进行性疾病,GA病变侵犯中央凹(负责中央视力)平均需要2.5年,会严重损害视觉功能、独立性和生活质量。
GA是由补体过度激活导致的不可逆损伤生长破坏视网膜细胞引起的。由于处于补体级联的中心位置,C3是能够精确控制补体级联的唯一靶标。Empaveli是一种靶向性补体C3疗法,旨在通过调节补体级联的过度激活,控制疾病的发生发展。
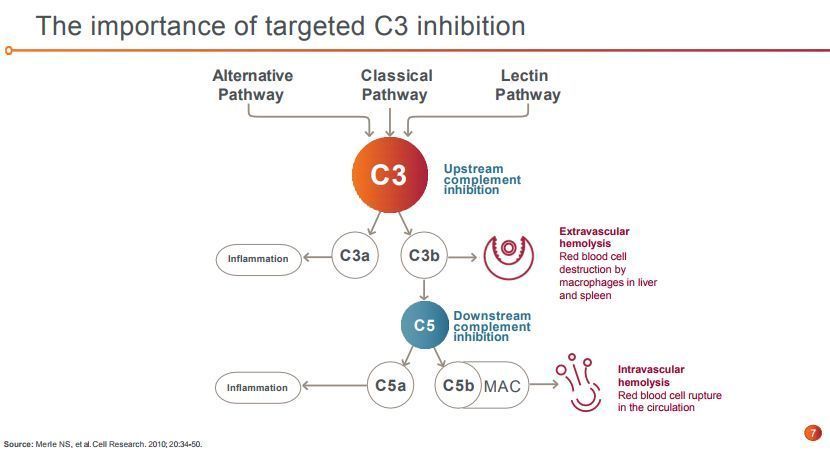
C3处于补体级联的中心位置
Empaveli的活性药物成分pegcetacoplan是一种靶向性C3抑制剂,旨在调节补体过度激活,这是导致许多严重疾病发生和发展的原因。pegcetacoplan是一种合成的环肽,与一种聚乙二醇聚合物结合,特异性地与C3和C3b结合。目前,pegcetacoplan正被开发用于治疗多种疾病,包括PNH、GA和C3肾小球病。在美国,FDA已授予pegcetacoplan治疗PNH和GA的快速通道资格。
Empaveli是第一种获得监管批准的C3靶向疗法,该药已于2021年5月获得美国FDA批准、2022年12月获得欧盟委员会(EC)批准上市:用于治疗阵发性睡眠性血红蛋白尿症(PNH)成人患者。适用于:(1)先前没有接受过治疗的PNH成人患者;(2)先前接受过C5抑制剂Soliris(eculizumab)和Ultomiris(ravulizumab)的PNH成人患者。
在过去十多年来,治疗PNH的唯一选择是C5抑制剂,但许多患者仍然经历持续性低血红蛋白症,常常导致虚弱的疲劳和频繁的输血。在临床试验中,Empaveli能针对PNH提供广泛的控制,通过增加血红蛋白水平及减少输血需求来改善PNH患者的生活。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


