Science:揭示特定tRNA通过招募CCR4-NOT复合物促进mRNA衰减机制
来源:生物谷原创 2024-11-27 11:42
这项研究表明,tRNA 还能发挥额外的功能,即不仅能解码 mRNA 和传递氨基酸,还能在翻译过程中与其他复合物接触,以调节翻译数量和 mRNA 的稳定性。
在一项新的研究中,来自德克萨斯大学西南医学中心的研究人员发现tRNA 可以决定 信使RNA(mRNA)在细胞中的存在时间,使一些遗传信息稳定下来并翻译成更多的蛋白,同时引导另一些遗传信息降解并限制蛋白的制造数量。相关研究结果发表在2024年11月22日的Science期刊上,论文标题为“Specific tRNAs promote mRNA decay by recruiting the CCR4-NOT complex to translating ribosomes”。

为抗击 SARS-CoV-2 病毒而开发的基于mRNA的疫苗挽救了生命,并在 COVID-19 大流行期间使得mRNA成为一个家喻户晓的名字。突然之间,每个人都对这种帮助将遗传信息转化为蛋白的分子有了更多的了解。但是,除了决定制造哪些蛋白外,mRNA 还能指定蛋白的产生数量。
论文共同通讯作者、德克萨斯大学西南医学中心的Joshua Mendell说,“了解这种调控非常重要,不仅因为我们想弄清基因是如何被控制的,还因为它可以帮助我们设计出更好的mRNA疗法。”
“如果我们向细胞提供一种 mRNA,那么如果能在该序列中编入精确的程序,说明它应该持续多长时间,应该制造多少蛋白,那将会非常棒。”
在这项新的研究中,Mendell及其团队和论文共同通讯作者、德克萨斯大学西南医学中心的Jan Erzberger及其团队报告了一种可以确定 mRNA 稳定性的新方法。他们发现,将 mRNA 信息转化为蛋白的过程会影响 mRNA 的持续时间,而一种名为精氨酸的氨基酸起着至关重要的作用。这些发现可能有助于开发治疗肥胖、癌症和线粒体疾病等多种疾病的新方法。
构建蛋白
为了制造蛋白,细胞将 DNA 中的遗传物质转录或复制到 mRNA 中。mRNA随后在一种叫做核糖体的结构中被翻译成蛋白。
在翻译过程中,核糖体沿着 mRNA 移动,在此过程中,一类叫做 tRNA的RNA 也会参与其中。不同的 tRNA一端有不同的三碱基“反密码子(anticodon)”,与 mRNA 中的互补“密码子”结合,另一端则是氨基酸。通过这种方式,tRNA 将 mRNA 编码的氨基酸转化为蛋白。
当 tRNA 与mRNA编码的遗传信息结合时,它们位于核糖体的不同位点,分别称为 A、P 和 E。tRNA 在 A 位点进入核糖体,而位于P 位点的 tRNA携带着不断生长的蛋白链。然后,蛋白链转移到位于 A 位点的tRNA 携带的氨基酸上,将其延长一个氨基酸单元。
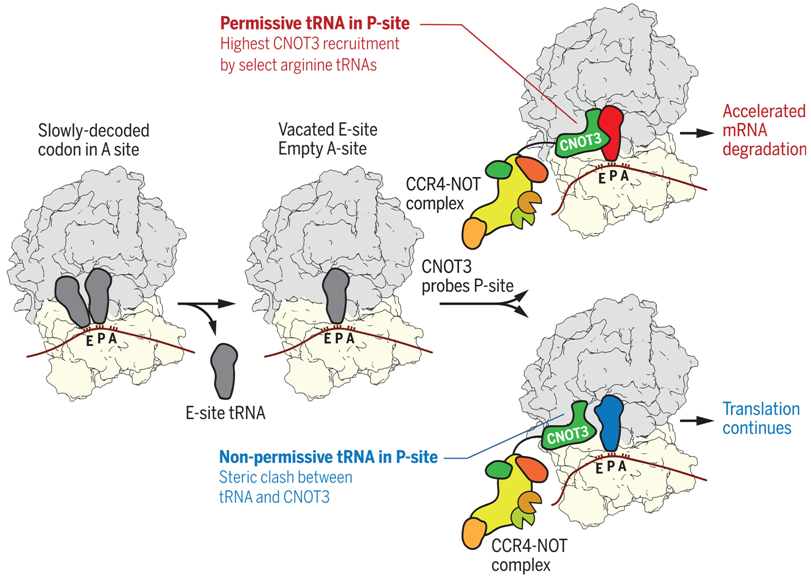
p位点的tRNA控制CCR4-NOT复合物对翻译核糖体的招募
当这种情况发生时,核糖体发生转移,将结合着新生蛋白的 tRNA 移到 P 位点,而将现在空着的 tRNA 移到 E 位点,准备离开。这样,A 位点就为新的 tRNA 留出了位置,以便将下一个氨基酸带入。如此循环往复,直到终止密码子告诉核糖体停止翻译。
对降解 mRNA 的新方法进行转化
Mendell团队知道,mRNA 的序列会影响其稳定性,但没有人知道这在哺乳动物细胞中是如何起作用的。以前在酵母中进行的研究表明,当翻译速度减慢时,核糖体中只剩下一个位于P位点的tRNA。当A位点和E位点长期处于空位时,一种名为CCR4-NOT的复合物就会降解mRNA遗传信息,从而减少蛋白的制造数量。
论文第一作者Xiaoqiang Zhu说,“在酵母中,A位点上的密码子在这一过程中起着重要作用,但在哺乳动物细胞中,我竟然没有检测到这种效应。”这揭示了酵母细胞与哺乳动物细胞之间的关键区别。虽然最初对这些结果感到失望,但Zhu的后来实验表明,P位点中tRNA的身份是关键。
Mendell说,“核糖体首先缓慢移动,就像在酵母中一样,这就给了CCR4-NOT复合物一个机会,让它把自己的一部分伸进核糖体,看看P位点的tRNA是什么。”
在哺乳动物细胞中,这些作者发现CCR4-NOT 最常与 P 位点中有特定精氨酸密码子的 mRNA 结合在核糖体上。
Erzberger说,“有趣的是,在编码精氨酸的六个密码子中,只有三个密码子被富集,这表明可以制造出两种类型的信息,它们可以以不同的速度被降解。”他说,人们认为精氨酸密码子是可以互换的,但这项研究对这一假设提出了挑战。
利用由论文共同作者Victor Cruz带头进行的结构生物学研究,他们还确定了 tRNA 允许或阻止 CCR4-NOT 结合所需的精确结构。
约翰-霍普金斯大学霍华德-休斯医学研究所研究员Rachel Green(未参与这项新的研究)说:,“这是一篇令人兴奋的论文,它的观察结果着实令人吃惊。该系统的复杂性令人震惊。”她补充说,这项研究解释了如何利用遗传密码和蛋白合成的基本原理来协调调节 mRNA。
“该系统的复杂性令人震惊"。她补充说,这项研究解释了如何利用遗传密码和蛋白质合成的基本原理,以一种意想不到的复杂方式对mRNA进行协调调控。
这种新的调控机制被称为P位点tRNA介导的mRNA衰变(P-site tRNA-mediated mRNA decay, PTMD),是参与代谢的线粒体的一种强有力的调控因素。正因为如此,这些发现有朝一日可能帮助科学家们为肥胖患者开发出新的疗法。线粒体在包括癌症在内的许多其他疾病中也发挥着重要作用,这些发现可能会对这些疾病产生影响。
PTMD的发现开辟了许多研究方向,这些作者计划继续深入研究。Erzberger 说,其他密码子也可能对翻译产生类似的影响,而 Mendell有兴趣了解有关 CCR4-NOT 招募的调控和生理作用的更多细节。
Mendell 说,“这项研究真正表明,tRNA 还能发挥额外的功能,即不仅能解码 mRNA 和传递氨基酸,还能在翻译过程中与其他复合物接触,以调节翻译数量和 mRNA 的稳定性。这真是令人兴奋。”(生物谷Bioon.com)
参考资料:
Xiaoqiang Zhu et al. Specific tRNAs promote mRNA decay by recruiting the CCR4-NOT complex to translating ribosomes. Science, 2024, doi:10.1126/science.adq8587.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


