艾伯维完成$630亿并购艾尔建,阿斯利康收回炎症性肠病新药IL-23单抗brazikumab全球权利!
来源:本站原创 2020-05-12 13:45
2020年05月12日讯 /生物谷BIOON/ --阿斯利康(AstraZeneca)近日宣布,已完成从艾尔建(Allergan)收回brazikumab(前称MEDI2070)的全球权利,这是一种针对白细胞介素23(IL-23)的单克隆抗体,治疗克罗恩病(CD)处于IIb/III期临床,治疗溃疡性结肠炎(UC)处于IIb期临床。阿斯利康与艾尔建已经终止了双

2020年05月12日讯 /生物谷BIOON/ --阿斯利康(AstraZeneca)近日宣布,已完成从艾尔建(Allergan)收回brazikumab(前称MEDI2070)的全球权利,这是一种针对白细胞介素23(IL-23)的单克隆抗体,治疗克罗恩病(CD)处于IIb/III期临床,治疗溃疡性结肠炎(UC)处于IIb期临床。
阿斯利康与艾尔建已经终止了双方之前的许可协议。因此,对brazikumab的所有权利现在都归阿斯利康所有,将增强阿斯利康的呼吸和免疫学管线,这也是该公司的三大重点治疗领域之一,另两个分别为肿瘤学、心血管&肾脏&代谢疾病。
今年5月8日,艾伯维宣布完成对艾尔建的收购。此次收购的资金规模高达630亿美元,收购完成后将催生出一个巨无霸生物制药公司。目前,在大型制药公司TOP15榜单上,艾伯维位居第10位。医药市场调研机构EvaluatePharma预测,收购完成后,艾伯维的排名将跃升至第4位,2026年的销售额预计将达到535.6亿美元。
在艾尔建与阿斯利康的这笔交易中,根据终止协议,艾尔建将为约定金额提供资金,估计将是阿斯利康在完成开发brazikumab用于克罗恩病(CD)和溃疡性结肠炎(UC)之前预计将产生的总成本,包括开发一款伴随诊断产品。
根据安进和阿斯利康在2012年共同开发和商业化一个临床阶段炎症产品组合(包括brazikumab)的合作,如果brazikumab获得监管批准并上市,安进有权基于销售额获得高个位数至低个位数的特许权使用费,这包括原始发明人的特许权使用费。除此之外,阿斯利康将拥有来自该药物的全部权利和利益,无需向安进或艾尔建支付其他款项。
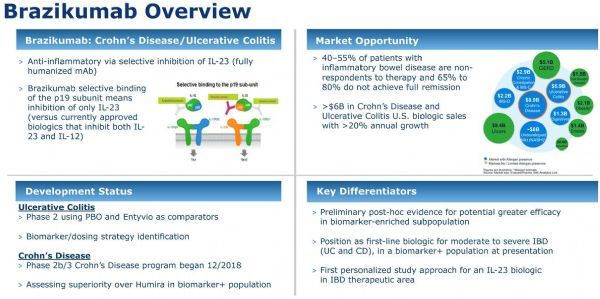
brazikumab是一种单克隆抗体药物,能够靶向结合IL-23受体,该药目前正在开发用于治疗具有一种伴随生物标志物的克罗恩病(CD)和溃疡性结肠炎(UC)。
brazikumab可选择性阻断IL23免疫信号,预防肠道炎症。在II期临床试验显示,在抗肿瘤坏死因子(TNF)耐药的CD患者中,brazikumab在治疗第8周就显示出了临床疗效。目前,IIb/III期INTREPID项目正在进行中,评估brazikumab、安慰剂、阿达木单抗(adalimumab)治疗CD的疗效。另一项II期EXPEDITION试验正在进行中,评估brazikumab、安慰剂、Entyvio(vedolizumab)治疗UC的疗效。
针对目前已上市的生物制剂,约40%-55%的患者对这些药物没有应答、65%-80%的患者接受治疗没有取得完全缓解。
目前,阿斯利康在呼吸和免疫学方面的中晚期生物药包括:(1)Fasenra(benralizumab),这是一种单抗药物,已被批准作为一种附加维持疗法,用于治疗重度嗜酸性粒细胞性哮喘,该药正在评估治疗严重哮喘以外的八种嗜酸性粒细胞驱动的疾病。Fasenra能够直接结合嗜酸性粒细胞上的白细胞介素5受体的α亚基(IL-5Rα),并独特地吸引自然杀死细胞(NK cell),通过细胞凋亡(程序性细胞死亡)诱导嗜酸性粒细胞的快速和几乎完全耗竭。(2)tezepelumab,这是一款首创抗TSLP单抗,处于III期临床治疗严重、不受控哮喘。(3)anifrolumab,这是一种与I型干扰素受体亚基1结合的全人单克隆抗体,治疗系统性红斑狼疮(SLE)预计2020年下半年提交监管申请,该药可阻断包括IFNα、IFNβ和IFN-ω在内的所有I型干扰素的活性,I型干扰素是参与炎症通路的细胞因子。(4)MEDI3506,这是一种靶向结合白细胞介素33(IL33)的单克隆抗体,处于II期临床,治疗皮肤病和其他炎症性疾病。
brazikumab临床项目所选择进行比较的对照药物中,阿达木单抗(修美乐,Humira)是艾伯维的一款旗舰炎症产品,该药是全球第一个获批的抗肿瘤坏死因子(TNF-α)药物,也是全球最畅销的抗炎药,上市10多年以来,凭借已批准的众多适应症、显著的疗效、良好的安全性已得到普遍认可。
自2012年以销售额95.96亿美元的战绩首次登上全球“药王”宝座以来,已经连续8年获得全球“药王”称号。2018年销售额199亿美元,2019年为191.69亿美元。截止2019年,全球阿达木单抗总销售额已超1551亿美元。

Entyvio是武田制药的一款肠道选择性生物制剂,这是一种单克隆抗体,能特异性拮抗α4β7整合素,抑制α4β7整合素对肠道黏膜细胞粘附分子MAdCAM-1的结合。MAdCAM-1选择性表达于肠胃血管和淋巴结。α4β7整合素表达于一组循环(circulating)白细胞,这些细胞已被证明在CD和UC疾病中介导炎症过程中发挥了重要作用。
目前,Entyvio静脉制剂(IV)已在全球60多个国家批准上市,皮下制剂(SC)已于最近获得欧盟批准。值得一提的是,Entyvio是欧洲唯一被批准针对UC和CD成人患者可同时提供静脉制剂(IV)和皮下制剂(SC)的维持疗法,将为患者在治疗方面提供更多的选择。
在中国,Entyvio IV(安吉优®,vedolizumab,注射用维得利珠单抗)于今年3月获得批准,适应症为对传统治疗或TNFα抑制剂应答不充分、失应答或不耐受的中重度活动性UC和CD成人患者。Entyvio(安吉优®)被列入第一批临床急需境外新药名单,获得了加快审评。
Entyvio(安吉优®)是目前炎症性肠病(IBD)领域唯一的肠道选择性生物制剂,其临床数据表明能够快速起效,并实现长期持久的临床缓解和黏膜愈合,同时安全性好,是欧美国际指南推荐的一线生物制剂。
从安吉优®(注射用维得利珠单抗)纳入第一批临床急需境外新药名单到它的快速获批,这充分显示了中国政府加速引入创新药物、不断提高人民健康生活的决心。该药在中国的批准上市,将为中国广大的中重度IBD患者提供一个新的治疗选择。(生物谷Bioon.com)
原文出处:AstraZeneca recovery of global rights to brazikumab (MEDI2070) from Allergan completed
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->