多篇重要研究成果解读科学家们在人类多发性硬化症研究领域取得的新成果!
多发性硬化症(MS)是人类最常见的一种中枢神经脱髓鞘疾病,目前全球大约有近300万人都患有该病,其会影响机体除神经系统外的所有器官,从而导致患者出现不同程度的功能障碍。
2023-05-26
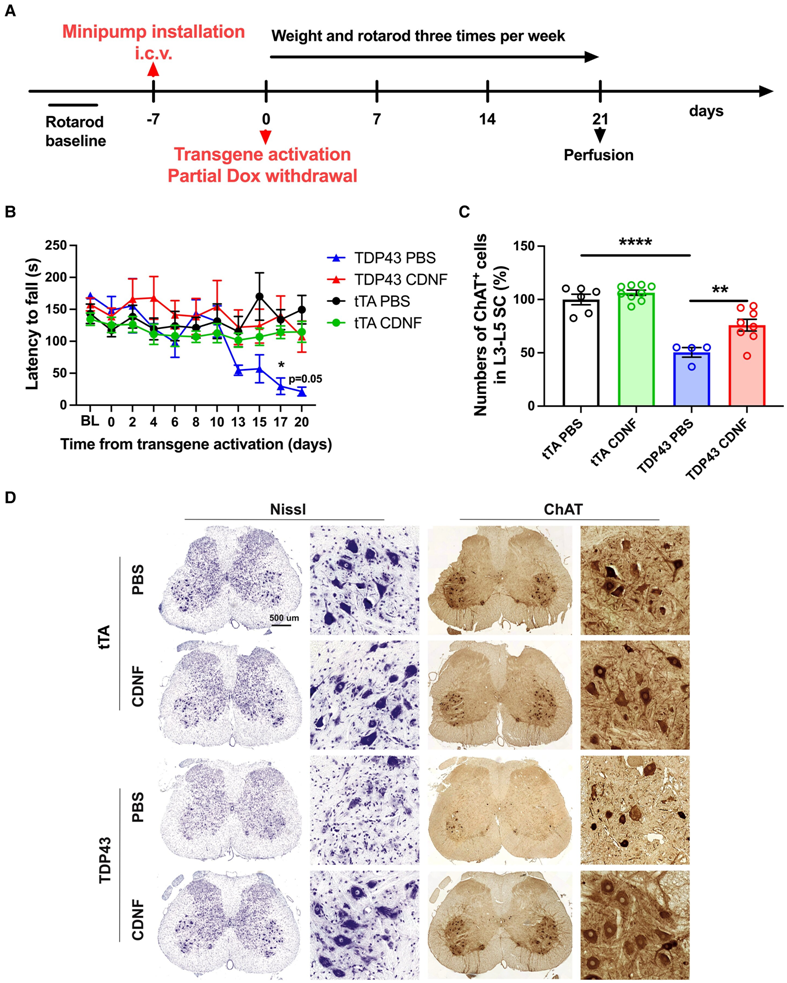
Brain:一种候选药物延长肌萎缩性侧索硬化症啮齿动物模型的寿命并缓解症状
在一项新的研究中,来自芬兰赫尔辛基大学等研究机构的研究人员发现了一种治疗肌萎缩性侧索硬化症(amyotrophic lateral sclerosis, ALS)的候选药物。在动物实验中,脑多巴胺神经
2023-09-26
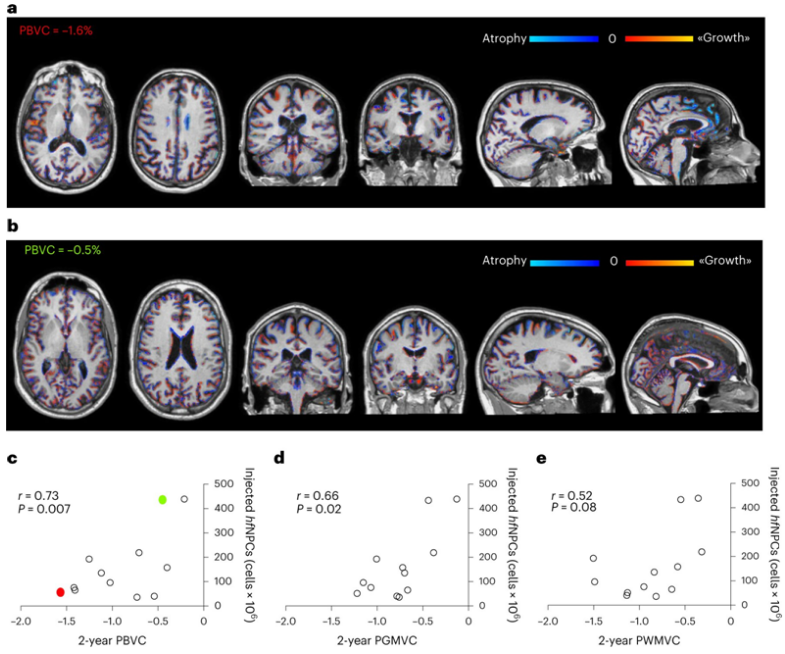
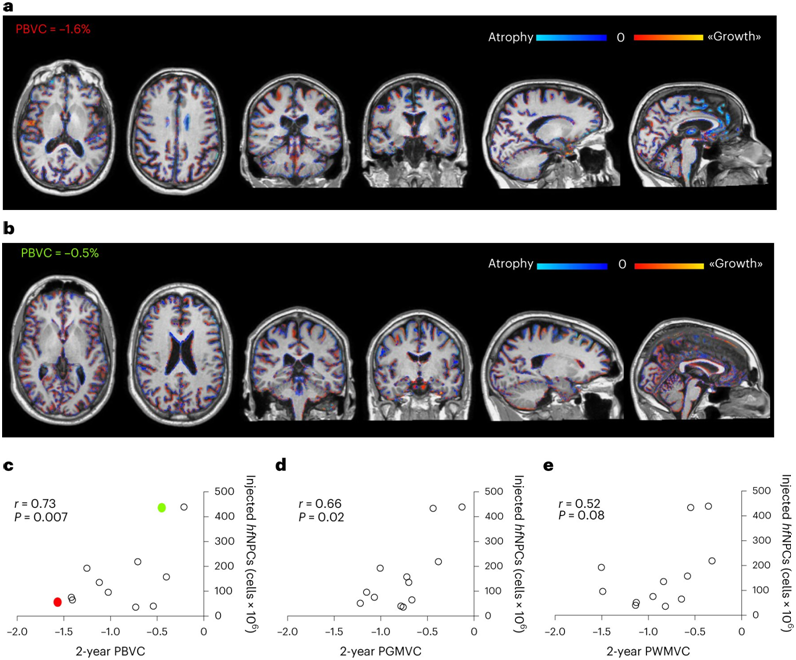
Nat Med:移植胎儿神经前体细胞有望治疗多发性硬化症
在一项新的研究中,来自意大利IRCCS圣拉斐尔科学研究所、圣拉斐尔生命健康大学、圣杰拉尔多医院和热那亚大学等研究机构的研究人员发现接受从流产胎儿中收集的神经前体细胞(neural precursor
2023-01-18
我国科学家发现与多发性硬化症相关的新基因
四川大学华西医院、成都医学院第三附属医院与海南省人民医院的一项联合研究发现,SHMT1,FAM120B和ICA1L基因可能与MS的发病机制有关。
2022-12-31
Nature子刊:首个胚胎干细胞治疗多发性硬化症临床试验结果发布
该研究尝试了一种治疗多发性硬化症的新方法。研究团队收集了捐赠的来自10-12周的流产胎儿的胚胎干细胞,并将其注射到多发性硬化症患者的脊柱中,并成功减少了患者的疾病标志物。
2023-01-12
Nature:利用FIND-seq成功分离和分析在多发性硬化症中发挥关键作用的星形胶质细胞亚群
在一项新的研究中,研究人员通过结合核酸细胞仪、微流控技术和液滴分选,开发出FIND-se,可根据数字液滴PCR检测的mRNA生物标志物的表达来分离和分析感兴趣的罕见细胞。
2023-01-12
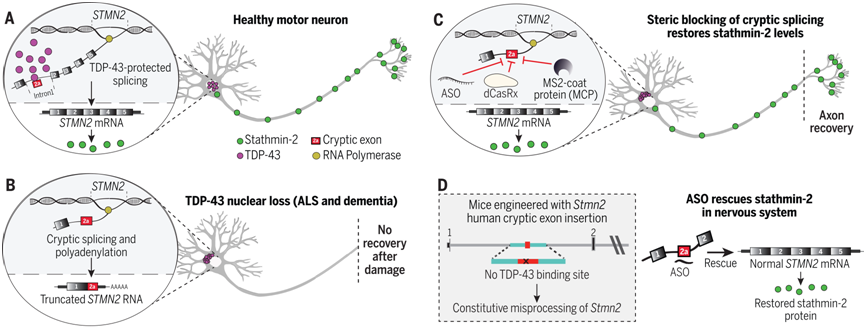
Science:利用人工设计的DNA药物有望延缓几乎所有的肌萎缩性脊髓侧索硬化症患者的瘫痪
在一项新的研究中,来自美国加州大学圣地亚哥分校、哈佛医学院和布罗德研究所等研究机构的研究人员证实stathmin-2的丢失可以用人工设计的DNA药物进行拯救,从而恢复编码蛋白的RNA的正常加工。
2023-03-30
多发性硬化创新药物「富马酸二甲酯」入医保,与中国患者期待“十年不复发”之约
新版医保目录的正式实行,将显著提高富马酸二甲酯肠溶胶囊的可及性,大幅度降低患者用药经济负担,进一步助力中国患者长期规范疾病管理。
2023-01-18