Nature:蝙蝠为何能携带致命病毒却安然无恙?解密蝙蝠免疫系统的进化奥秘
来源:生物探索 2025-02-02 10:39
研究通过Bat1K项目提供的十种蝙蝠高质量基因组数据,并结合115种哺乳动物的基因组比较分析,揭示了蝙蝠独特的免疫适应机制。
在人类历史上,病毒大流行屡次改变世界格局,而蝙蝠(Chiroptera)一直被认为是众多高致病性病毒的自然宿主。从埃博拉(Ebola)、马尔堡(Marburg)到SARS(严重急性呼吸综合征)和新冠病毒(SARS-CoV-2),蝙蝠体内潜伏着大量能够跨越种族屏障的病原体。然而,令人惊讶的是,尽管携带着这些高危病毒,蝙蝠本身却几乎从未出现严重的感染症状。这种现象背后的生物学奥秘,长期以来吸引着研究人员的关注。
1月29日Nature的研究报道“Bat genomes illuminate adaptations to viral tolerance and disease resistance”,通过Bat1K项目提供的十种蝙蝠高质量基因组数据,并结合115种哺乳动物的基因组比较分析,揭示了蝙蝠独特的免疫适应机制。研究发现,蝙蝠的免疫基因在演化过程中经历了显著的正向选择(positive selection),尤其是在调控抗病毒和炎症反应的关键基因上。这一发现提供了新的证据,解释了为何蝙蝠在病毒感染后能够保持无症状状态,同时也对理解人类疾病的发生与免疫调控具有重要意义。
在众多免疫适应性变化中,ISG15基因的演化尤为突出。ISG15是一种抗病毒蛋白,在人类感染新冠病毒时被发现与过度炎症反应相关。然而,研究发现某些蝙蝠的ISG15不仅能够有效抵御SARS-CoV-2,还不会引发人体常见的免疫风暴(cytokine storm)。通过深入分析ISG15的氨基酸突变模式,研究人员揭示了蝙蝠如何通过精妙的分子调控,实现对病毒的耐受性和抗性。这一研究结果不仅深化了人们对蝙蝠抗病毒能力的认识,也为未来抗病毒治疗提供了潜在的新靶点。
随着新发传染病的频繁爆发,解读自然界中病毒宿主的免疫策略变得尤为重要。蝙蝠作为地球上唯一能持续飞行的哺乳动物,它们独特的生理和免疫特征或许正是解开病毒共存与防治之谜的关键。未来的研究有望借助这些基因组学发现,推动人类疾病防控的新突破,让我们更好地应对未知的病毒威胁。

蝙蝠的秘密——它们为何能抵御致命病毒?
当提及蝙蝠(Chiroptera),大多数人首先想到的是夜间飞行、回声定位,或者与哥特文化相关的神秘形象。然而,在病毒学和传染病研究领域,蝙蝠还有另一个更引人关注的称号——“病毒库”(reservoir of viruses)。研究显示,蝙蝠是全球已知携带病毒最多的哺乳动物之一,可携带来自31个病毒家族的成员,其中包括多种高致病性病毒,如冠状病毒(Coronaviridae)、丝状病毒(Filoviridae,如埃博拉和马尔堡病毒)、副粘病毒(Paramyxoviridae,如亨德拉病毒和尼帕病毒)以及狂犬病毒(Rabies virus)。
在基于ZOVER数据库的研究中,研究人员利用宏基因组数据对蝙蝠和啮齿动物体内的病毒种类进行了系统性分析,结果发现蝙蝠体内的病毒种类远超啮齿动物。其中,蝙蝠体内检测到的病毒序列中,有17.8%属于冠状病毒,而啮齿动物中仅为1.4%(P = 5 × 10⁻⁵⁰)。进一步分析发现,在蝙蝠的不同家族中,蹄蝠科(Rhinolophidae)和菊头蝠科(Hipposideridae)体内的病毒中,分别有41.6%和31.7%属于冠状病毒,这表明这些蝙蝠家族可能是冠状病毒的重要宿主。这一发现也与之前的流行病学调查相吻合,SARS、MERS和SARS-CoV-2的自然宿主均被认为来源于蹄蝠科的成员。
从埃博拉到新冠,蝙蝠与人类传染病的联系
近年来,许多高致病性病毒的人畜共患病(zoonotic diseases)爆发,都与蝙蝠密切相关。例如:
-
亨德拉病毒(Hendra virus)和尼帕病毒(Nipah virus):由飞狐(Pteropodidae)传播,可引发严重的脑炎或呼吸道疾病,致死率高达40%~75%。
-
埃博拉病毒(Ebola virus)和马尔堡病毒(Marburg virus):可能源自果蝠(Pteropodidae),导致剧烈出血热,致死率最高可达90%。
-
狂犬病病毒(Rabies virus):蝙蝠是北美洲主要的狂犬病毒携带者,每年导致人类和动物死亡。
-
SARS、MERS和新冠病毒(SARS-CoV-2):均属于冠状病毒家族,在蝙蝠体内发现了高度相似的病毒株,被认为是病毒溢出(spillover)的主要来源。
值得注意的是,冠状病毒在蝙蝠中的分布最为广泛,研究人员在全球21个蝙蝠科中发现了至少15个家族的蝙蝠携带冠状病毒。这种广泛的病毒宿主性,使蝙蝠成为新发传染病研究的焦点。
令人惊讶的现象:蝙蝠自身却几乎不受病毒影响
尽管蝙蝠携带大量高致病性病毒,但它们自身却很少表现出严重的感染症状。这种现象在实验室研究中得到了直接证实。例如,在对蹄蝠科蝙蝠进行的实验感染中,研究人员发现:
-
感染SARS样冠状病毒或马尔堡病毒的蝙蝠体内,病毒能够有效复制,但它们几乎不出现临床症状。
-
埃及果蝠(Rousettus aegyptiacus)感染马尔堡病毒后,尽管体内病毒载量升高,但不会激活强烈的炎症反应,也没有组织损伤的明显迹象。
这些研究结果表明,蝙蝠在应对病毒感染时,可能拥有独特的免疫调控机制。研究人员推测,蝙蝠的特殊免疫适应性可能与飞行相关的高代谢状态有关。飞行会产生大量的自由基(reactive oxygen species, ROS),如果不加以控制,会对细胞造成损伤。蝙蝠进化出了一种高效的抗氧化和免疫调控机制,既能应对飞行带来的生理压力,又能在病毒感染时保持适当的免疫反应,而不会陷入炎症失控的状态。
破解蝙蝠免疫系统的基因密码
Bat1K项目:建立高质量蝙蝠基因组库
为了深入解析蝙蝠独特的免疫适应性,研究人员发起了Bat1K项目,这是一项国际合作计划,旨在构建高质量的蝙蝠基因组数据,为全球研究人员提供深入探索蝙蝠生理特性的基础工具。该项目的目标是:
-
对多种蝙蝠物种进行全基因组测序,特别是具有重要生理特征(如长寿、高病毒携带率、免疫耐受)的种类;
-
提高基因组组装精度,通过三代测序(PacBio)、Hi-C和RNA测序等多种技术手段,生成接近染色体水平的基因组数据;
-
为进化生物学、免疫学和病毒学研究提供高质量的基因组参考,帮助研究人员更精准地解析蝙蝠的特殊生理机制。
在该研究中,研究人员利用Bat1K项目生成的10种蝙蝠的高质量基因组数据,结合其他哺乳动物物种的数据,进行大规模基因组比较分析。这一数据资源的建立,为后续的免疫基因筛选和进化适应研究奠定了坚实的基础。
115种哺乳动物基因组比对:寻找特殊的免疫基因
要理解蝙蝠为何能抵御病毒,研究人员不仅要分析蝙蝠自身的基因组,还需要将其与其他哺乳动物进行比较。该研究收集了115种哺乳动物的基因组数据,通过系统比对,寻找蝙蝠在免疫相关基因上的独特进化模式。
研究发现,蝙蝠的免疫基因在进化过程中经历了强烈的正向选择(positive selection),特别是在以下几个关键免疫通路中:
-
干扰素刺激基因(ISGs, Interferon-Stimulated Genes):这些基因在病毒感染时被激活,是宿主抗病毒防御的核心组成部分。与其他哺乳动物相比,蝙蝠的ISGs表现出显著的适应性变化。
-
炎症调控基因:研究显示,蝙蝠体内的炎症相关基因,如NLRP3(炎症小体关键成分),其功能被显著抑制,这可能解释了为何蝙蝠在病毒感染时不会出现过度的炎症反应。
-
病毒受体基因:某些蝙蝠种群的病毒受体基因(如ACE2, ANPEP等)发生了独特的突变,可能影响病毒与宿主细胞的结合方式,使其对某些病毒具有天然的抵抗力。
值得注意的是,ISG15基因的进化变化最为显著,它在不同蝙蝠种群中发生了独特的氨基酸替换,使其在抗SARS-CoV-2病毒时表现出更强的抑制能力。
研究目标:揭示蝙蝠抗病毒的遗传基础
基于这些基因组分析结果,研究人员提出了两个核心问题:
-
蝙蝠的免疫基因如何在进化过程中被选择?为什么蝙蝠的ISGs、炎症调控基因和病毒受体基因发生了特异性变化?这些变化如何影响病毒感染后的免疫应答?
-
蝙蝠的免疫耐受机制如何运作?为何蝙蝠能在病毒感染后保持无症状状态,而其他哺乳动物会出现严重疾病?这种特殊的免疫调控是否与蝙蝠的高代谢、长寿和飞行能力有关?
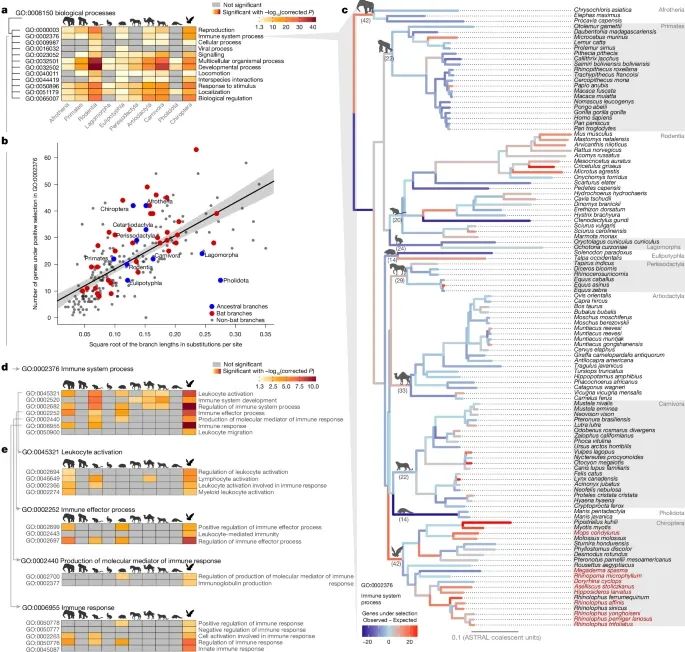
免疫相关基因的选择在蝙蝠中最为显著(Credit: Nature)
(a) 免疫相关基因的正向选择富集分析
研究人员对多个哺乳动物类群的基因组进行分析,检测哪些基因经历了正向选择(positive selection),并对这些基因的功能进行富集分析(GO生物学过程)。结果显示,蝙蝠的免疫相关基因富集程度明显高于其他哺乳动物类群,说明蝙蝠的免疫系统在进化过程中经历了更强的选择压力。图中的矩阵展示了不同哺乳动物类群(列)中,受到正向选择的基因所涉及的GO生物学过程(行),其中有颜色的单元格代表在该类群中显著富集的功能类别。
(b) 免疫基因正向选择的进化趋势
研究人员构建了一个线性回归模型,探讨免疫基因的正向选择与进化速率之间的关系。结果表明,一个物种(或分支)中经历正向选择的基因数量,与该分支的演化速率(以分支长度的平方根表示)之间存在显著的正相关关系。这意味着,进化速率较快的哺乳动物(如蝙蝠)往往在免疫相关基因上经历更强的适应性进化,这可能是它们适应独特生态环境(如飞行、高病毒接触率)所导致的结果。
(c) 115种哺乳动物的免疫基因选择信号分布
研究人员在115种哺乳动物的系统发生树上绘制了每个分支免疫基因正向选择的强度。颜色编码:不同分支的颜色表示该分支的免疫相关基因正向选择程度,即观察到的正向选择基因数量与回归模型预测值之间的差值:颜色越暖(红色、橙色)表示免疫基因的正向选择强度高于预期。颜色越冷(蓝色)表示免疫基因的正向选择强度低于预期。结果表明,蝙蝠的进化分支在免疫基因选择方面表现出异常高的富集信号,进一步验证了蝙蝠的免疫系统经历了强烈的自然选择,以适应其特殊的生活方式(如飞行、高群体密度生活、频繁接触病毒等)。
(d) 免疫系统GO分类的富集分析
研究人员进一步分析了GO分类体系中,“免疫系统过程”(immune system process)的子分类,以确定哪些具体免疫功能在蝙蝠中被特别强化。结果显示,蝙蝠的免疫基因在多个子分类中均表现出显著的正向选择信号,涉及抗病毒防御、炎症调控和干扰素信号通路等关键生物学过程。
(e) 免疫子功能的深入分析
该部分进一步细化了免疫相关GO分类的子项,展示蝙蝠在具体免疫功能上的独特性。研究人员发现,与炎症调节、干扰素反应和抗病毒免疫直接相关的基因,在蝙蝠中经历了最强的正向选择,支持了前述结论,即蝙蝠进化出了一种高度优化的免疫策略,使其能够携带大量病毒但不发病。
病毒与宿主:为什么蝙蝠如此特殊?
高病毒携带率:蝙蝠与31种病毒家族的关系
在所有已知的哺乳动物中,蝙蝠(Chiroptera)被认为是病毒多样性最丰富的宿主之一。研究表明,蝙蝠可以携带来自31种病毒家族的成员,包括许多对人类和其他动物具有高度致病性的病原体。例如:
-
冠状病毒科(Coronaviridae):包括SARS、MERS和SARS-CoV-2,这些病毒在不同种类的蹄蝠(Rhinolophidae)体内均被发现。
-
丝状病毒科(Filoviridae):埃博拉病毒(Ebola virus)和马尔堡病毒(Marburg virus)被认为源自果蝠(Pteropodidae)。
-
副粘病毒科(Paramyxoviridae):亨德拉病毒(Hendra virus)和尼帕病毒(Nipah virus)均由飞狐(Pteropodidae)传播。
-
狂犬病毒(Rabies virus)及相关病毒:在多个蝙蝠种群中被广泛发现。
相比之下,其他哺乳动物,即使是啮齿类动物,其病毒宿主范围也远不及蝙蝠广泛。一个关键问题随之而来:为什么蝙蝠能够携带如此多的病毒,而不会像人类或其他动物一样出现严重疾病?
不发病的秘密:蝙蝠的免疫调控机制
尽管蝙蝠体内存在大量高致病性病毒,但它们自身却几乎不表现出明显的感染症状。这一现象的核心,可能与蝙蝠特化的免疫调控机制密切相关。研究人员发现,蝙蝠的免疫系统在多个层面上表现出独特的适应性,包括:
-
干扰素(IFN)系统的持续激活:许多哺乳动物在受到病毒感染时,才会激活I型干扰素(IFN-I)系统,而蝙蝠的某些种类,如大蹄蝠(Rhinolophus ferrumequinum),即使在没有感染的情况下,干扰素基因仍保持高水平表达。这一机制可能使蝙蝠的细胞始终处于“高度戒备”状态,在病毒侵入的早期阶段就能迅速应对,从而抑制病毒的扩散。
-
限制炎症反应,避免免疫过激:在许多病毒感染的病理过程中,宿主免疫系统的过度反应往往是导致严重症状的主要原因。例如,在新冠病毒(SARS-CoV-2)感染中,免疫风暴(cytokine storm)是导致肺部损伤和多器官衰竭的主要因素。研究发现,蝙蝠的NLRP3炎症小体(inflammasome)被抑制,这使得它们在病毒感染时,即使病毒在体内复制,也不会引发强烈的炎症反应,避免免疫系统对自身组织造成损害。此外,蝙蝠体内的某些免疫基因,如IL-6(白细胞介素-6)和TNF-α(肿瘤坏死因子-alpha),其表达水平显著低于其他哺乳动物,从而减少了免疫细胞的过度活化风险。
-
优化的DNA损伤修复机制:飞行是哺乳动物中仅有蝙蝠能实现的高能耗运动,而飞行会产生大量的自由基(ROS, Reactive Oxygen Species),容易造成DNA损伤。研究发现,蝙蝠进化出了高效的DNA修复机制,能够迅速修复因代谢压力或病毒感染导致的DNA损伤,减少因病毒整合或基因突变而引发的免疫异常。这一机制可能与某些抗病毒基因的演化相关,例如IFN刺激基因15(ISG15),该基因在某些蝙蝠种群中发生了特定突变,使其不仅具有抗SARS-CoV-2的作用,同时也能避免免疫系统的过度激活。
炎症反应的两难:如何在抗病毒与自身免疫伤害之间平衡?
在生物演化中,抗病毒免疫和自我保护之间存在一个“平衡点”。如果免疫反应过于强烈,虽然可能有效清除病毒,但也可能造成自身组织损伤;相反,如果免疫反应过于温和,则可能让病毒在体内大量复制,最终导致致命感染。蝙蝠的免疫系统似乎在这一两难困境中找到了最优解:
-
通过持续激活抗病毒基因(如干扰素通路),在病毒进入早期就有效抑制复制,而不需要依赖强烈的炎症反应。
-
降低炎症通路的活性,减少由免疫系统自身引起的损伤,即使病毒存在,也不会引发宿主过度反应。
-
优化DNA修复机制,使其能够承受高代谢带来的损伤,同时增强抗病毒适应性。
这一“免疫低反应”策略,在进化上赋予蝙蝠极大的生存优势,使它们能够在高病毒负荷的环境中生存,同时避免因病毒感染而导致的高死亡率。而在人类和其他哺乳动物中,免疫系统的反应方式往往更加极端,要么成功清除病毒,要么因过度炎症而导致疾病加重。这也是为什么SARS、MERS等冠状病毒在人类感染后,往往会诱发严重的肺部炎症,而在蝙蝠体内却能够保持长期共存。
关键发现一:蝙蝠免疫基因的进化适应
在哺乳动物中,蝙蝠的免疫系统展现出独特的适应性,使其成为高病毒携带率但低发病率的特殊宿主。这一特性被认为是长期进化的结果,尤其与蝙蝠独特的生活方式密切相关。
首先,蝙蝠是唯一具有持续飞行能力的哺乳动物,飞行过程中产生的高代谢率会带来大量的活性氧(ROS, Reactive Oxygen Species),这些自由基如果不能有效清除,会导致细胞损伤和基因突变。为了应对这种代谢压力,蝙蝠的DNA修复系统和免疫系统发生了适应性进化,形成了更强的抗病毒能力和更温和的炎症应对机制。
其次,蝙蝠的群居生活和广泛的地理分布也为病毒传播提供了理想环境。大量个体在狭小空间内共同生活,增加了病毒的传播频率,而蝙蝠的迁徙行为更进一步促进了病毒在不同生态环境中的流动。这一生态特性,使得蝙蝠长期暴露于多种病毒,促使其免疫系统不断进化,以适应这种高病原压力的生存环境。
研究人员分析了10种蝙蝠基因组,并与115种哺乳动物的基因组数据进行比对,发现蝙蝠的免疫基因组展现出显著的正向选择压力,远超其他哺乳动物。
免疫基因选择压力的加强:远超其他哺乳动物的正向选择
进化生物学中的正向选择(positive selection),指的是在自然选择的驱动下,某些基因因其有利的突变得以保留和增强,以适应特定的生存压力。研究显示,蝙蝠的免疫基因在进化过程中经历了远强于其他哺乳动物的正向选择,尤其是在以下几个关键基因通路中:
-
干扰素(IFN)信号通路的适应性进化:研究发现,蝙蝠的I型干扰素受体基因IFNAR1、IFNAR2发生了多次突变,这些突变可能影响干扰素信号的调控,使蝙蝠能够在不触发强烈免疫反应的情况下,维持长期抗病毒状态。进一步分析表明,与其他哺乳动物相比,蝙蝠的干扰素相关基因在未感染状态下就维持高表达,这一特性可能赋予其更快的初始免疫反应能力。
-
炎症小体(inflammasome)的调控进化:炎症小体是细胞识别病原体并触发免疫反应的重要分子复合体。在大多数哺乳动物中,NLRP3炎症小体在病毒感染时被激活,导致细胞因子释放,引发炎症反应。然而,蝙蝠的NLRP3基因发生了功能性削弱,使其在病毒感染后不会出现剧烈的炎症反应,这也是蝙蝠能够耐受高病毒负荷但不发病的关键原因之一。研究人员发现,NLRP3基因在蝙蝠中的适应性突变,使其蛋白功能受到抑制,这与蝙蝠极低的炎症水平相吻合。
-
抗病毒基因ISG15的适应性进化:ISG15(干扰素刺激基因15)是一种在抗病毒免疫反应中起重要作用的蛋白。在人类和许多哺乳动物中,ISG15可通过促进炎症来增强抗病毒反应,但这种机制在某些情况下会引发免疫风暴(cytokine storm),导致严重的组织损伤。研究发现,蝙蝠的ISG15基因在多个物种中均发生了特异性突变,这些突变增强了ISG15的抗病毒能力,同时避免了过度炎症反应。例如,在中美蹄蝠(Myotis myotis)中,ISG15发生的氨基酸替换使其能够更有效地抑制SARS-CoV-2的复制,而不会激活强烈的炎症反应。
这一系列基因进化适应表明,蝙蝠在病毒压力下,形成了一种独特的低炎症、高抗病毒的免疫策略,使其能够在不影响自身健康的情况下,与病毒长期共存。
免疫反应的双刃剑:为何蝙蝠能避免过度炎症?
在病毒感染过程中,免疫系统的激活是一把“双刃剑”:适度的免疫反应有助于清除病毒,但过度激活可能导致组织损伤,甚至危及生命。人类在感染新冠病毒(SARS-CoV-2)后,常见的严重症状之一就是免疫风暴,由过量释放的炎症因子(如IL-6、TNF-α)引发的广泛性炎症损伤。然而,蝙蝠在病毒感染后,能有效控制炎症,避免宿主自身受到损害。
研究表明,蝙蝠能够避免过度炎症,主要依赖以下几种机制:
-
抑制炎症小体的激活:NLRP3炎症小体的功能性抑制,使蝙蝠在感染病毒后,能够减少促炎因子的释放,防止免疫反应过度。
-
特异性抑制IL-6和TNF-α的表达:在其他哺乳动物中,IL-6和TNF-α的过度激活会导致急性呼吸窘迫综合征(ARDS),是新冠病毒感染导致严重肺炎的主要原因之一。然而,蝙蝠的免疫系统在病毒感染后,IL-6和TNF-α的表达水平显著低于其他物种,这可能是其耐受病毒感染但不发生严重病理反应的关键因素。
-
高效DNA修复与抗氧化能力:由于蝙蝠长期适应飞行带来的生理压力,其体内的DNA修复系统比其他哺乳动物更加高效,能够迅速修复由病毒感染或免疫反应引起的细胞损伤。研究显示,蝙蝠的SIRT1基因(与DNA修复和抗氧化相关)在多个物种中均表现出正向选择,使其能够更有效地抵抗因炎症反应导致的细胞损伤。
关键发现二:ISG15基因如何帮助蝙蝠抗病毒?
ISG15的双重功能:抗病毒 vs. 炎症调控
在哺乳动物的免疫系统中,ISG15(干扰素刺激基因15,Interferon-Stimulated Gene 15)是一种关键的抗病毒因子。它通过多种机制干预病毒感染,包括直接抑制病毒复制和调控宿主免疫反应。ISG15的作用主要体现在以下两个方面:
-
抗病毒功能:ISG15是一种小分子蛋白,可以通过ISGylation(ISG化修饰),与宿主和病毒蛋白结合,从而影响病毒生命周期。例如,在人类细胞中,ISG15可抑制SARS-CoV-2的复制,但其具体机制仍在研究中。研究发现,某些蝙蝠种类的ISG15在抑制病毒复制方面比人类更有效。在细胞实验中,来自大蹄蝠(Rhinolophus ferrumequinum)和中美蹄蝠(Myotis myotis)的ISG15能够显著降低SARS-CoV-2的复制水平。
-
炎症调控功能:在人类和其他哺乳动物中,ISG15不仅具有抗病毒作用,还能通过调节NF-κB信号通路影响炎症反应。过量的ISG15可能导致炎症失控,使机体在应对病毒感染时陷入免疫风暴(cytokine storm),这正是新冠肺炎(COVID-19)重症患者中常见的现象。相比之下,蝙蝠的ISG15展现出不同的调控模式,它不仅能有效抗病毒,还能避免触发过度炎症,从而降低病毒感染对宿主的损害。
这一发现提示,蝙蝠ISG15可能具备特殊的进化适应性,使其能够在抗病毒和免疫调控之间取得平衡。
特定氨基酸突变:如何增强蝙蝠的抗SARS-CoV-2能力?
为了进一步解析蝙蝠ISG15为何具有更强的抗病毒能力,研究人员对不同物种的ISG15蛋白序列进行了比对,并发现:
-
某些蝙蝠种群的ISG15蛋白发生了关键氨基酸突变,这些突变可能影响其与宿主蛋白或病毒蛋白的相互作用,从而增强其抗病毒功能。
-
其中,特别值得关注的是位于ISG15 C端的氨基酸替换,这些突变可能改变了ISG15的空间结构,提高其结合宿主免疫蛋白(如USP18)的能力,从而增强对病毒的抑制作用。
实验数据表明:
-
在细胞培养实验中,表达蝙蝠ISG15的细胞对SARS-CoV-2的敏感性显著降低,病毒RNA水平下降了3~5倍,而人类ISG15则未能达到同样的效果。
-
进一步的功能实验表明,蝙蝠ISG15可以更有效地干扰病毒的nsp3蛋白(冠状病毒复制过程中关键的蛋白酶),从而抑制病毒基因组的复制。
这些发现说明,蝙蝠ISG15的特异性突变,使其在抗SARS-CoV-2的能力上优于人类,这可能是蝙蝠能够长期携带冠状病毒却不发病的重要分子机制之一。
为什么人类的ISG15可能导致免疫风暴,而蝙蝠不会?
在新冠病毒(SARS-CoV-2)感染中,一个常见的致死因素是免疫风暴,即免疫系统对病毒的过度反应,导致严重的肺部炎症和多器官损伤。ISG15在其中扮演了一个复杂的角色:
-
在人类免疫系统中,ISG15不仅能帮助清除病毒,还会通过激活NF-κB信号通路,促进促炎细胞因子的释放,如IL-6和TNF-α。在COVID-19患者中,过量的ISG15表达与高水平的炎症因子密切相关,这可能是导致严重肺损伤的原因之一。
-
然而,蝙蝠的ISG15似乎进化出了避免这一副作用的能力。研究表明:蝙蝠ISG15的氨基酸突变可能降低了其对NF-κB信号的激活能力,使其在抗病毒的同时不会引发过度炎症。蝙蝠体内的USP18表达水平较高,USP18是一种可以拮抗ISG15促炎作用的蛋白,能抑制NF-κB通路,从而降低炎症反应。在实验室小鼠中,如果人为抑制USP18,会导致炎症水平显著升高,提示这一机制可能在炎症控制中起关键作用。
因此,蝙蝠在病毒感染后的免疫策略是:
-
增强ISG15的抗病毒作用,快速抑制病毒复制;
-
减少ISG15对炎症因子的激活作用,防止免疫风暴发生;
-
通过USP18等调控因子,进一步抑制过度炎症,确保机体在抗病毒的同时不会遭受免疫损伤。
这些特性使得蝙蝠能够在携带病毒的同时保持健康,而在人类等其他哺乳动物中,ISG15的炎症激活效应往往会导致病毒感染后的严重病理损伤。
关键发现三:蝙蝠的病毒耐受性与飞行的关系
高代谢如何驱动免疫系统的特殊演化?
蝙蝠是唯一能够持续飞行的哺乳动物,这一特性决定了它们的生理代谢必须高度适应高能耗环境。在飞行过程中,蝙蝠的代谢率可比静息状态提高15倍以上,这意味着其体内会产生大量活性氧(ROS, Reactive Oxygen Species)。高水平的ROS会损伤DNA、蛋白质和细胞膜,理论上应导致较高的衰老速率和疾病风险,但蝙蝠却演化出了高度耐受氧化应激和组织损伤的能力。
研究人员对蝙蝠的基因组分析发现,在多个代谢相关基因(如SIRT1、FOXO3等)上,蝙蝠表现出正向选择(positive selection),这意味着这些基因的突变在进化过程中被自然选择保留,并赋予蝙蝠更强的DNA修复能力和抗炎症特性。
这一发现提出了一个有趣的假设:飞行对蝙蝠的免疫系统施加了特殊的选择压力,使其进化出更高效的DNA修复机制,同时抑制不必要的免疫反应。换句话说,蝙蝠的免疫系统并非单纯为了应对病毒而演化,而是为了适应高代谢带来的生理挑战,同时无意间形成了一种更强的病毒耐受性。
炎症抑制机制如何帮助蝙蝠适应高速飞行?
在大多数哺乳动物中,免疫系统在应对感染时会触发炎症反应,以限制病原体的扩散。然而,炎症是一种高能耗过程,涉及免疫细胞的大量募集、细胞因子的释放以及组织修复,而这些生理活动都需要额外的代谢投入。对于蝙蝠而言,频繁飞行已经占用了极大的生理资源,如果再加上强烈的炎症反应,可能会严重影响其生存能力。因此,蝙蝠的免疫系统演化出了一种低炎症、高耐受的策略,以减少不必要的能量消耗。
研究人员分析了蝙蝠的NLRP3炎症小体(inflammasome),这一蛋白复合体在炎症反应中起着关键作用。在许多病毒感染(如SARS-CoV-2)中,NLRP3的过度激活会引发免疫风暴(cytokine storm),导致严重的肺部损伤和多器官衰竭。然而,蝙蝠的NLRP3表现出以下几个独特的适应性变化:
-
NLRP3基因突变削弱了其活性,使其对病毒感染的反应更加温和,避免了过度的炎症损伤。
-
蝙蝠体内的IL-1β(炎症因子)表达水平较低,这进一步降低了免疫系统对病原体的过度反应。
-
SIRT1基因(与抗氧化和DNA修复相关)在蝙蝠中被高度表达,可以有效抑制炎症信号通路,同时增强细胞对高代谢环境的适应能力。
这些机制表明,蝙蝠的免疫系统在进化过程中并非专门为了应对病毒,而是为了在飞行这一高代谢状态下生存,优先抑制了可能浪费能量的炎症过程,从而意外获得了更强的病毒耐受性。
炎症体(inflammasome)调控:为何蝙蝠不会因病毒感染而严重发病?
在病毒感染时,宿主的免疫反应通常依赖于炎症体的激活,以清除病原体。然而,在大多数情况下,病毒引起的疾病并非完全由病毒本身造成,而是由宿主自身的免疫反应所导致。例如,在COVID-19的重症病例中,患者的肺部损伤并非直接由SARS-CoV-2病毒破坏,而是由免疫系统释放的大量细胞因子引发的炎症反应所致。
蝙蝠之所以能够携带大量病毒却不发病,主要归因于炎症体的特殊调控机制。研究人员发现:
-
NLRP3基因的功能性抑制:许多哺乳动物在病毒感染后,会通过NLRP3炎症小体激活IL-1β,导致强烈的炎症反应。然而,蝙蝠的NLRP3基因在进化过程中发生了特定突变,使其对病毒的敏感性降低,从而减少了炎症因子的释放。在实验中,研究人员发现,即使在高病毒负荷下,蝙蝠体内的IL-1β表达水平仍然较低,这表明其免疫系统能够有效控制炎症反应,而不会引发剧烈的组织损伤。
-
干扰素(IFN)信号通路的优化:研究表明,蝙蝠在未感染时,I型干扰素(IFN-I)通路已经处于低水平持续激活的状态,这意味着在病毒进入体内的早期,蝙蝠已经做好了“免疫防御”准备,无需依赖炎症反应来应对病毒扩散。这一特性使得蝙蝠可以在不触发强烈炎症的情况下控制病毒,避免因免疫过激而导致的组织损伤。
-
SIRT1和FOXO3等抗炎基因的高度表达:SIRT1是一种能够调控抗氧化应激和炎症反应的基因,在蝙蝠中被高度表达。研究发现,SIRT1可以抑制NF-κB信号通路,减少促炎因子的释放,从而降低炎症反应的强度。FOXO3是一种参与细胞应激反应的转录因子,在蝙蝠中同样表现出较强的正向选择。FOXO3的高表达可能有助于增强细胞存活能力,同时减少因病毒感染而导致的细胞凋亡。
这些发现揭示了蝙蝠如何在病毒感染后,利用特殊的炎症调控机制,既能有效抵御病毒,又能避免免疫系统对自身的伤害。这种独特的免疫策略,使得蝙蝠成为一个高度耐受病毒的“超级宿主”。
未来:从蝙蝠基因组中寻找抗病毒新策略
能否利用蝙蝠的免疫策略开发新疗法?
蝙蝠独特的免疫系统,使其在长期携带高致病性病毒的同时,几乎不表现出任何临床症状。这一特性不仅是病毒生态学的谜题,也为人类医学提供了新的思考方向。如果能够解码蝙蝠如何平衡抗病毒免疫与低炎症反应,或许可以开发出更有效的抗病毒治疗策略,甚至优化人类自身的免疫反应。
随着基因编辑技术(如CRISPR-Cas9、基因疗法)的发展,已经可以在一定程度上精准调控基因表达,那么是否可以借鉴蝙蝠的免疫策略,优化人类免疫系统以提高病毒抵抗力?
未来的公共卫生启示:如何减少人类与蝙蝠的病毒传播风险?
蝙蝠不仅是重要的生态系统成员,也是多种高致病性病毒的自然宿主。随着人类活动的扩张,人类与蝙蝠的接触频率增加,这也提高了病毒跨种传播(spillover events)的风险。为了减少蝙蝠病毒对人类的威胁,公共卫生领域可以采取以下措施:
-
加强野生动物与人类的隔离:避免在蝙蝠栖息地附近进行大规模开发,减少对蝙蝠种群的干扰。通过立法,禁止或严格监管野生蝙蝠的捕猎和食用,防止病毒跨物种传播。
-
监测蝙蝠体内的病毒种类和变异:建立全球蝙蝠病毒数据库,持续监测蝙蝠携带的冠状病毒、丝状病毒等高风险病原体的演化情况。利用NGS(下一代测序技术)和人工智能分析,预测可能发生跨种传播的病毒突变,为疫苗和抗病毒药物研发提供前瞻性数据支持。
-
优化疫苗和抗病毒药物的开发:目前许多疫苗针对的是单一病毒株,但蝙蝠病毒往往具有较强的跨种传播能力,因此可以研究广谱疫苗(universal vaccines),提高对不同病毒变异株的保护效果。结合蝙蝠免疫系统的特点,开发更温和的抗病毒药物,减少因免疫风暴引发的并发症。
尽管目前仍有许多未解之谜,但蝙蝠的免疫奇迹已经为研究人员提供了新的探索方向。未来,随着生物技术的不断进步,我们或许能够解锁蝙蝠的免疫密码,并将这些发现转化为新的医学突破,帮助人类更好地应对病毒挑战,减少未来大流行的风险。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


