Cell重磅:AI从头设计生成小型结合蛋白,大幅提高先导编辑效率
来源:生物世界 2025-08-07 12:21
在这项最新研究中,研究团队利用 RFdiffusion 来抑制错配修复(MMR)通路,从而提高先导编辑(PE)效率。
自 CRISPR-Cas9 基因组编辑技术问世以来,人们为拓展其应用范围付出了大量努力,从而开发出了碱基编辑器(Base editor,BE)和先导编辑器(Prime editor,PE)。
碱基编辑器能够转换单个或少数几个碱基,而先导编辑器能够引入碱基替换以及小的片段插入和缺失。由于其灵活性和精准性,先导编辑器在包括细胞和基因治疗以及疾病建模在内的治疗应用方面正受到越来越多的关注。然而,先导编辑器受限于其较低的编辑效率,因此,人们探索了各种策略以提高先导编辑效率。
2025 年 8 月 5 日,首尔国立大学医学院的研究人员在国际顶尖学术期刊 Cell 上发表了题为:AI-generated MLH1 small binder improves prime editing efficiency 的研究论文。
该研究利用 David Baker 团队开发的 AI 蛋白质设计工具——RFdiffusion,设计了靶向抑制错配修复(MMR)通路的 MLH1 小型结合蛋白(MLH1-SB),并使用 AlphaFold3 从设计的候选蛋白中高效筛选最佳蛋白——一个仅由 82 个氨基酸组成的 MLH1-SB,其可与当前的各种先导编辑器兼容适配,在人类细胞和小鼠体内大幅提高先导编辑效率。
这项研究凸显了生成式人工智能(generative AI)在推进基因组编辑技术方面的巨大潜力。
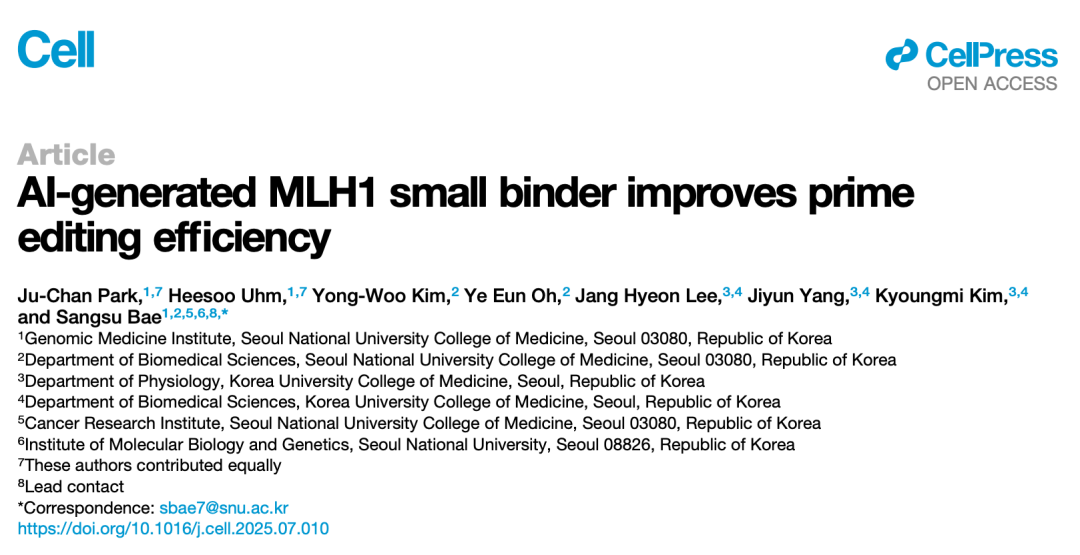
PE2 是一种优化的 PE 架构,由融合了逆转录酶(RT)的 Cas9 切口酶(nCas9)组成,可在目标位点合成包含所需编辑的 DNA 链。此过程依赖于作为逆转录模板的先导编辑向导 RNA(pegRNA)的 3' 端延伸。为了提高 PE 的效率,PE3 和 PE5 采用了一种额外的切口向导 RNA(ngRNA),在未编辑的链上制造第二个切口,使悬突平衡(flap equilibrium)向期望的编辑方向偏移。
进一步的研究表明,细胞中固有的错配修复(MMR)途径会阻碍在目标位点上所需编辑的整合。在错配修复中,MutS 同源物(MutSα 由 MSH2-MSH6 组成,MutSβ 由 MSH2-MSH3 组成)识别错配,并招募 MutLα 复合物(由 MLH1 和 PMS2 组成)以促进修复。
因此,抑制关键的错配修复组分(例如 MSH2、MSH3、MSH6、MLH1 和 PMS2)可显著提高 PE 效率。基于这一点,PE4 通过同时递送 MLH1dn 蛋白(用于移植 MutLα 复合物)和先导编辑器,以提高 PE 效率。然而,近期的研究显示,只有对大约 10 bp 或更小片段的编辑时,抑制 MMR 途径才能提高 PE 效率。
为了进一步提高 PE 效率,在 pegRNA 的 3' 末端引入了 RNA 假结结构基序,以增强其稳定性并防止 3' 末端延伸部分的降解。此外,利用噬菌体辅助连续进化技术(PACE)进行蛋白质进化,已开发出多种 PE6 架构,其编辑效率得到了提高。
此外,还有研究使用小 RNA 结合外切核酸酶保护因子 La 来保护 pegRNA 的 3' 端,从而开发了效率更高的 PE7。
尽管上述研究在提高先导编效率术方面取得了许多进步,但其编辑效率仍不尽如人意,尤其是在治疗应用方面。此外,重要的是要在不使用切口向导 RNA(ngRNA)的情况下改进先导编辑结构,因为 ngRNA 可能会引入意外的插入/缺失突变。
近年来,人工智能(AI)技术的进步使得基于序列的蛋白质结构预测以及蛋白质的从头设计成为可能。而且,AI 技术已被应用于开发基于 CRISPR 基因编辑工具。
但 AI 驱动的 CRISPR 基因组编辑改进,主要集中在提高关键酶(例如核酸酶 Cas9 和 脱氨酶 TadA)的催化活性上。此外,诺奖得主、蛋白质设计先驱 David Baker 开发的 用于设计结合蛋白的 AI 工具——RFdiffusion,很大程度上仅限于设计单结合位点结合蛋白以及抗体。
在这项最新研究中,研究团队利用 RFdiffusion 来抑制错配修复(MMR)通路,从而提高先导编辑(PE)效率。
这是通过两步策略实现的:1)从头设计具有多个结合位点的全新蛋白质,包括一个非竞争性锚定位点、一个靶向关键活性的抑制位点以及一个单纯的竞争性结合位点;2)采用基于 AlphaFold3 的筛选系统来挑选最佳候选蛋白质。
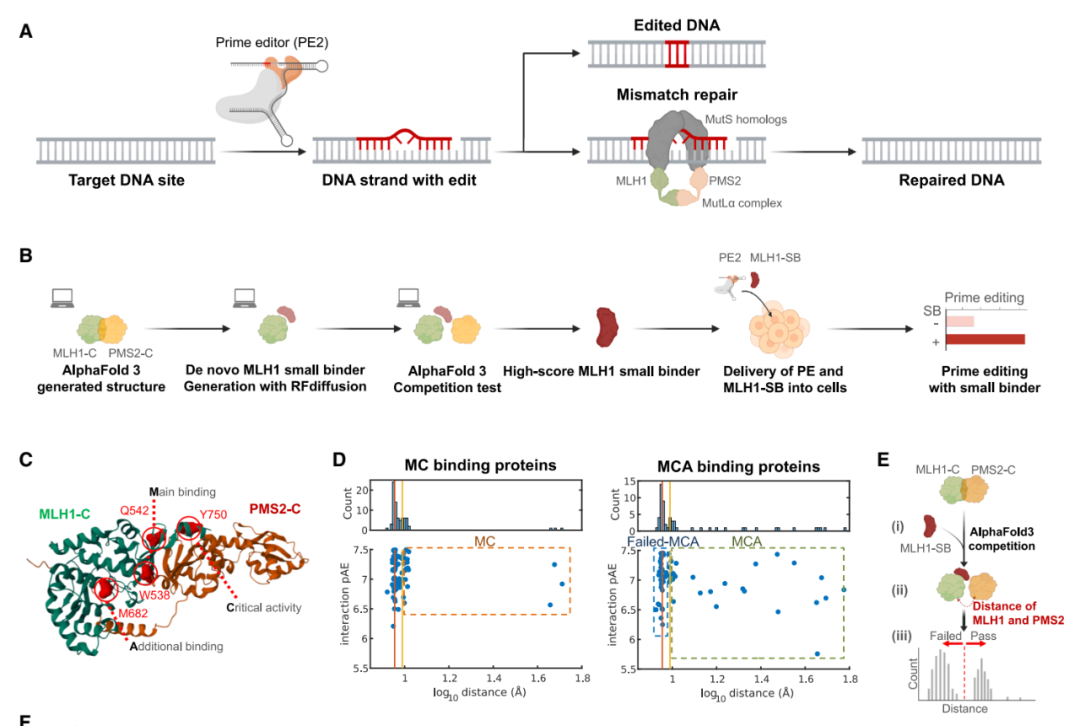
通过这种方法,研究团队利用 RFdiffusion 生成了一系列 MLH1 的小型结合蛋白——MLH1-SB,显著提高了 PE 效率,并且与现有的 PE 架构兼容,包括 PE2、PEmax、PE6 和 PE7。
在这些生成的 MLH1-SB 中,研究团队从中确定了一个仅由 82 个氨基酸组成的最优 MLH1-SB,其紧凑的结构使其能够无缝整合到现有的 PE 架构(PEmax、PE6 和 PE7)中,从而开发出诸如 PEmax-SB、PE6-SB 和 PE7-SB 这样的 PE-SB 平台。相比之下,MLH1dn 蛋白的多达 753 个氨基酸,体积庞大,难以整合和递送。
值得注意的是,PE7-SB2 系统通过融合了两个 MLH1-SB,在人类细胞中表现出显著提高的 PE 效率,分别比 PEmax 和 PE7 提高了约 18.8 倍和 2.5 倍。此外,体内研究显示,在小鼠体内,PE7-SB2 的 PE 效率相比 PE7 提高了约 3.4 倍。
鉴于腺相关病毒(AAV)和脂质纳米颗粒(LNP)等体内基因治疗递送方法的有效载荷能力,该研究中通过 AI 从头设计并生成的 MLH1-SB 能够在保持最小尺寸的同时显著增强 PE 效率,预计将促进高效的体内基因编辑疗法的开发。
该研究的亮点:
RFdiffusion 生成的 MLH1 小型结合蛋白(MLH1-SB)抑制错配修复活性;
AlphaFold 3 识别出有效的 MLH1 小型结合蛋白;
MLH1 小型结合蛋白可提高先导编辑效率且毒性有限;
MLH1 小型结合蛋白的紧凑尺寸使其能够集成到先导编辑架构中。

最后,研究团队表示,生成式人工智能(generative AI)工具的快速发展正在改变学术界和产业界的研究格局。该研究中使用了便捷的网页版 RFdiffusion,仅用 3 天时间就快速生成了 MLH1-SB,而且无需本地高算力支持,此外,使用 AlphaFold3 高效筛选蛋白,只用了 1 天时间,整个过程仅花费 4 天时间。这种高成功率、高效率,大大缩短了后续实验所需的时间和成本。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


