《自然》:刷新认知!科学家首次发现,阿尔茨海默病等神经退行性疾病的tau纤维竟有共同的中间体
来源:奇点糕 2023-12-15 12:09
本研究详细解析了tau蛋白(包含氨基酸残基297-391)在体外组装成具有AD或CTE折叠特征的淀粉样蛋白纤维过程中形成的中间产物的种类及结构。
许多神经退行性疾病,如阿尔茨海默病(AD)、额颞叶痴呆和慢性创伤性脑病(CTE)等,虽然临床症状存在差异,但有一个共同的病理特征,即患者大脑中存在错误折叠的tau蛋白纤维[1, 2]。
这些错误折叠的tau蛋白纤维可像朊病毒一样,以自身为模板进行自我扩增,成为神经退行性疾病发生和进展的基础。近年来,有研究表明,虽然这些疾病以tau蛋白聚集为特征,但这些疾病相关的纤维之间存在细微的结构差异,这些结构差异会对疾病的进展产生深远影响[3]。然而,研究人员尚不清楚不同的tau蛋白纤维构象是如何产生形成的。
近日,来自英国剑桥大学分子生物学实验室的Sjors H. W. Scheres和Michel Goedert领导的团队,在《自然》发表重磅研究成果[4]。
他们使用时间分辨冷冻电镜,对重组截短的tau蛋白(包含氨基酸残基297-391)在体外组装成类似AD和CTE中淀粉样蛋白纤维的过程,进行了细致研究,确认了这两种疾病状态的淀粉样蛋白纤维具有共同的“第一中间淀粉样蛋白”(FIA,有序核心结构由氨基酸残基302–316构成)。
FIA存在时间较短,大约在体外组装反应120分钟时产生,但在180分钟时就几乎消失。在稍后的时间里,取而代之的是许多不同的中间淀粉样蛋白纤维丝。在两个体外组装反应结束时,大多数中间淀粉样蛋白纤维丝消失,仅剩下具有与人脑中淀粉样蛋白纤维相同有序核心结构的纤维丝。
本研究为tau蛋白形成的淀粉样蛋白纤维组装的初级和次级成核过程中的中间产物提供了详实的结构数据,不同疾病相关的淀粉样蛋白纤维形成过程中并非毫无关联,而是可能存在共同的中间产物,这对新的靶向疗法的设计具有重要意义。

论文首页截图
由于淀粉样蛋白纤维组装过程中产生的中间产物存在时间很短暂,大多数关于中间产物结构的数据来自于重组蛋白的体外组装反应。此外,仅有tau蛋白在体外条件下组装产生的纤维与人脑中纤维结构相同,且在不同体外条件下可产生不同疾病特异的淀粉样蛋白纤维。
比如,在含有氯化镁的磷酸盐缓冲液中,tau蛋白可形成具有与AD患者淀粉样蛋白纤维相同有序核心结构的成对螺旋纤维(PHF)[5]。而在含氯化钠的磷酸盐缓冲液中,形成纤维的有序核心结构则与CTE患者大脑中提取的淀粉样蛋白纤维相同[3]。
为了进一步研究淀粉样蛋白纤维组装过程中中间产物的结构,研究人员使用时间分辨冷冻电镜来表征tau蛋白在体外组装成PHF或CTE相关纤维期间形成的丝状中间产物的结构。
研究人员首先表达并纯化了重组人tau蛋白(包含氨基酸残基297-391)。溶液状态核磁共振(NMR)证实了无序tau单体的存在,并显示残基305-314和336-345具有成为延展构象的趋势,这与全长tau蛋白构成的β-链中的构象类似。
随后,研究人员在两个不同溶液状态下开展了tau蛋白组装反应。第一个反应是在氯化镁磷酸缓冲液中进行以形成PHF,第二个反应是在氯化钠磷酸缓冲液以形成CTE相关纤维。
在经过冷冻电镜观测后,研究人员发现在反应30、60和90分钟时,溶液中不存在蛋白纤维,而到了反应120分钟后才出现淀粉样蛋白纤维。在之后的时间里,则逐渐出现许多其他类型的淀粉样蛋白纤维。

体外PHF组装反应溶液中不同时间点冷冻电镜下纤维状态
令人意外的是,两种不同溶液中在120分钟时首先出现的蛋白纤维具有相同的结构。这些蛋白纤维具有串珠样外观,长短不一,研究人员称之为FIA。
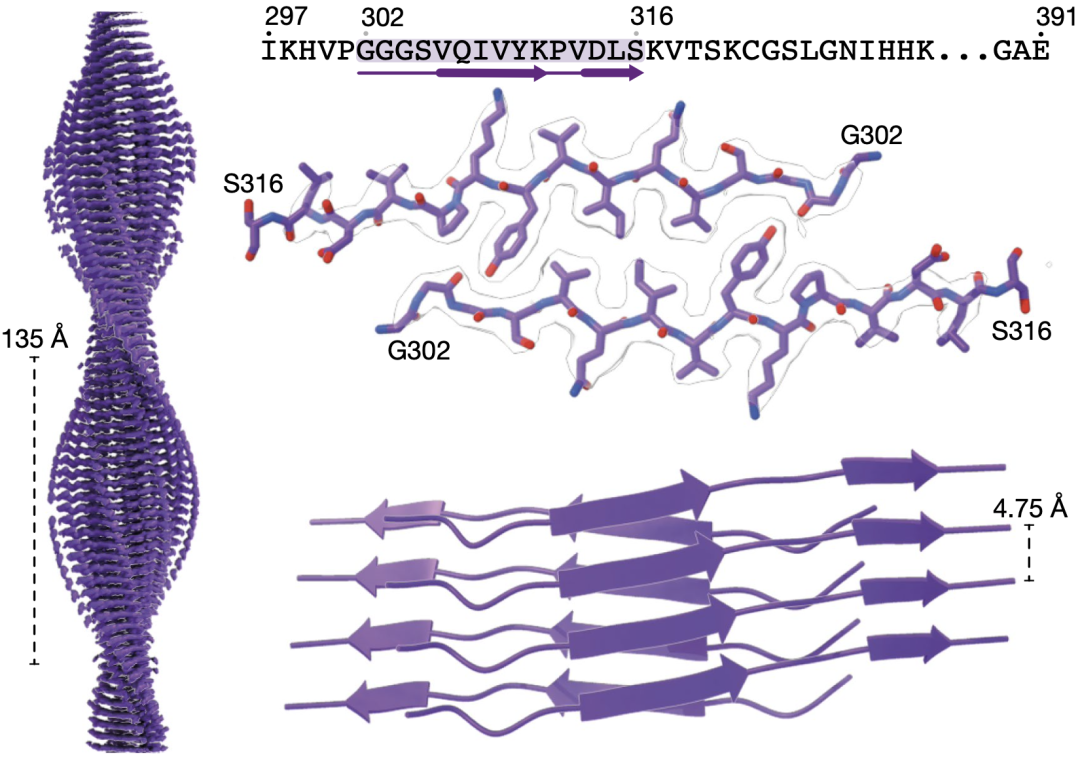
解析的FIA结构
FIA的有序核心结构由两个反向平行的tau蛋白残基序列302-316(GGGSVQIVYKPVDLS)构成,具有疏水的紧密堆积界面。在其中心,来自相对纤维的306缬氨酸和308异亮氨酸的侧链彼此堆积,两侧则是由310酪氨酸的侧链构成。
FIA只存在很短的时间,其在反应120分钟时产生,到180分钟时就几乎消失殆尽。这一现象表明FIA的初级成核过程是限速的,并且一旦形成,FIA可以通过次级成核机制引发其它淀粉样蛋白纤维的形成。从180分钟开始,研究人员在两种溶液中观察到了多种其他类型的纤维。
在形成PHF的组装反应中,反应180分钟时,大多数纤维由两个具有有序核心结构(包括残基305-380)的纤维组成,这一有序核心结构已与AD患者PHF的有序核心结构类似[5]。不同的是,AD患者PHF的折叠是C形的,但反应180分钟时溶液中大多数纤维的有序核心为更修长的J形构象。
随着时间的推移,在反应240-360分钟之间,具有两个J形构象的蛋白纤维逐渐变为具有一个J形构象和一个C形构象的蛋白纤维。到反应720分钟时,大多数纤维已经变为具有与AD患者PHF相同有序核心结构的纤维。
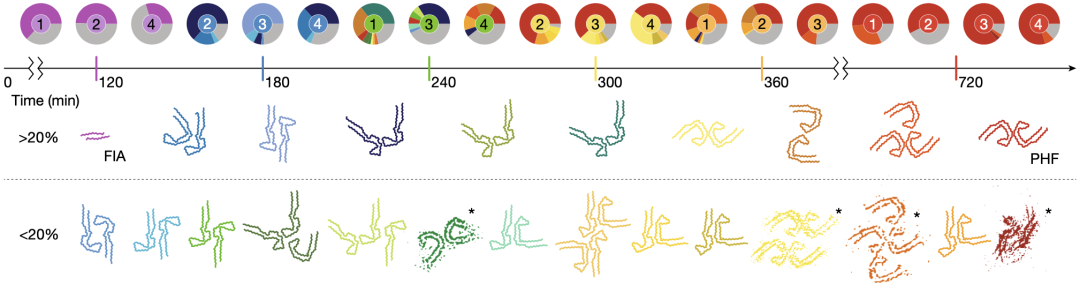
在形成PHF的组装反应中各种中间产物构象和丰度
在形成CTE相关蛋白纤维的组装反应中,形成了比PHF反应中更多的中间产物。与形成PHF反应时一样,大多数蛋白纤维由两个具有包含残基305-380的有序核心结构的原纤维组成,并且原纤维以多种方式相互堆积。大多数蛋白纤维在早期也为J形构象,并且随着时间的推移,出现了更多的C形构象的纤维。
不同之处在于,形成CTE相关蛋白纤维的组装反应中形成的大多数中间产物包括两个相同构象的纤维(即双J构象或双C构象)。
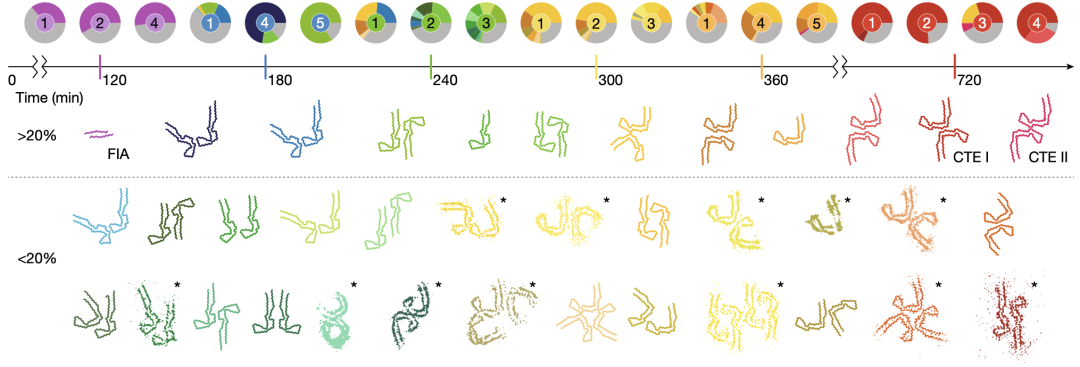
在形成CTE相关蛋白纤维的组装反应中各种中间产物构象和丰度
总的来说,本研究详细解析了tau蛋白(包含氨基酸残基297-391)在体外组装成具有AD或CTE折叠特征的淀粉样蛋白纤维过程中形成的中间产物的种类及结构。这些短暂存在的中间产物是否可以作为生物化学稳定的实体分离出来,从而可以产生针对的抗体仍有待进一步研究。
此外,本研究结果表明,体外疾病特异性tau蛋白折叠的形成是通过tau蛋白单体直接成核形成FIA,然后FIA再通过多种次级成核途径变成成熟的淀粉样蛋白纤维完成的,这其中涉及许多不同的中间体淀粉样蛋白纤维。这一结果为tau蛋白相关淀粉样蛋白纤维形成的初级和次级成核提供了新的见解,并为治疗药物的设计提供了新的途径。
参考文献
1.Peng C, Trojanowski JQ, Lee VM: Protein transmission in neurodegenerative disease. Nat Rev Neurol 2020, 16(4):199-212.
2.Wilson DM, 3rd, Cookson MR, Van Den Bosch L, Zetterberg H, Holtzman DM, Dewachter I: Hallmarks of neurodegenerative diseases. Cell 2023, 186(4):693-714.
3.Falcon B, Zivanov J, Zhang W, Murzin AG, Garringer HJ, Vidal R, Crowther RA, Newell KL, Ghetti B, Goedert M et al: Novel tau filament fold in chronic traumatic encephalopathy encloses hydrophobic molecules. Nature 2019, 568(7752):420-423.
4.Lovestam S, Li D, Wagstaff JL, Kotecha A, Kimanius D, McLaughlin SH, Murzin AG, Freund SMV, Goedert M, Scheres SHW: Disease-specific tau filaments assemble via polymorphic intermediates. Nature 2023.
5.Fitzpatrick AWP, Falcon B, He S, Murzin AG, Murshudov G, Garringer HJ, Crowther RA, Ghetti B, Goedert M, Scheres SHW: Cryo-EM structures of tau filaments from Alzheimer's disease. Nature 2017, 547(7662):185-190.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


