CIR:CTLA-4抑制剂疗效“拉胯”的原因,找到了!
来源:奇点糕 2023-12-28 09:18
FcγRIIB还不仅是抗CTLA-4单抗的“拦路虎”啊。虽然PD-1/L1抑制剂并不主要依赖Fc段激活ADCC/ADCP效应而起效,但后续针对其它免疫检查点开发单抗类抑制剂
作为免疫检查点抑制剂中的“前辈”,抗CTLA-4单抗们这些年来的发展着实不算理想,从获批适应证的角度来说,它们的单药治疗用法寥寥无几,基本只能和PD-1/L1抑制剂们搭档,要是看临床研究的失败案例就更是扎心了。
那么问题来了,绊住抗CTLA-4单抗的是什么呢?美国洛克菲勒大学团队刚刚发表在Cancer Immunology Research上的一项研究成果就给出了解释:抑制性IgG受体FcγRIIB会给抗CTLA-4单抗下绊子,作为免疫检查点抑制抗体依赖的细胞介导的细胞毒性作用/吞噬作用(ADCC/ADCP),导致抗CTLA-4单抗无法有效清除调节性T细胞,疗效因此大打折扣[1]。

论文首页截图
此前有许多基础研究都显示,人体肿瘤微环境内的调节性T细胞普遍存在CTLA-4高表达,而抗CTLA-4单抗Fc段激活ADCC/ADCP效应来清除调节性T细胞,是它们发挥抗肿瘤活性的关键[2],但这种效应在人类患者身上的复现并不理想[3]。
洛克菲勒大学的研究团队认为,导致上述情况的原因可能是人类癌症患者与基础研究使用小鼠模型间的差异,特别是单抗Fc段对应的Fcγ受体(FcγRs)结构、功能和表达水平在人鼠之间可能区别很大,因此决定使用CTLA-4和FcγRs人源化小鼠模型,评估全人源抗CTLA-4单抗是否能清除肿瘤中的调节性T细胞,如若不能,那就得把原因弄清楚。
初步实验显示,研究者们构建的CTLA-4/FcγRs人源化小鼠模型,基本能够复现人类癌症患者的肿瘤和免疫浸润情况;而以伊匹木单抗或Tremelimumab两种已获批的抗CTLA-4单抗Fc段处理小鼠,都不能有效清除调节性T细胞,它们的抗肿瘤作用主要来自对CD8+T细胞的激活,和当前临床实践中观察到的情况一致。
但调节性T细胞表面明明有CTLA-4表达,抗CTLA-4单抗为什么拿它们没办法呢?研究者们又用伊匹木单抗的Fc段构建靶标为CD4的抗体,发现即使换个靶标也没什么杀伤力,因此问题出在肿瘤微环境里,有某种机制限制了单抗Fc段激活ADCC/ADCP的杀伤效应,那首先就得从Fc段结合的FcγRs中查起。
流式细胞术分析显示,人源化小鼠模型肿瘤中浸润的免疫细胞,一大部分表面存在FcγRIIB的表达,而将抗CTLA-4单抗与阻断FcγRIIB的单抗联合使用,或是调整现有抗CTLA-4单抗的Fc段,使其对FcγRIIB的亲和力减弱,就能大幅增强抗CTLA-4单抗清除调节性T细胞的能力,调节性T细胞少了,抗肿瘤免疫强度就上来了。
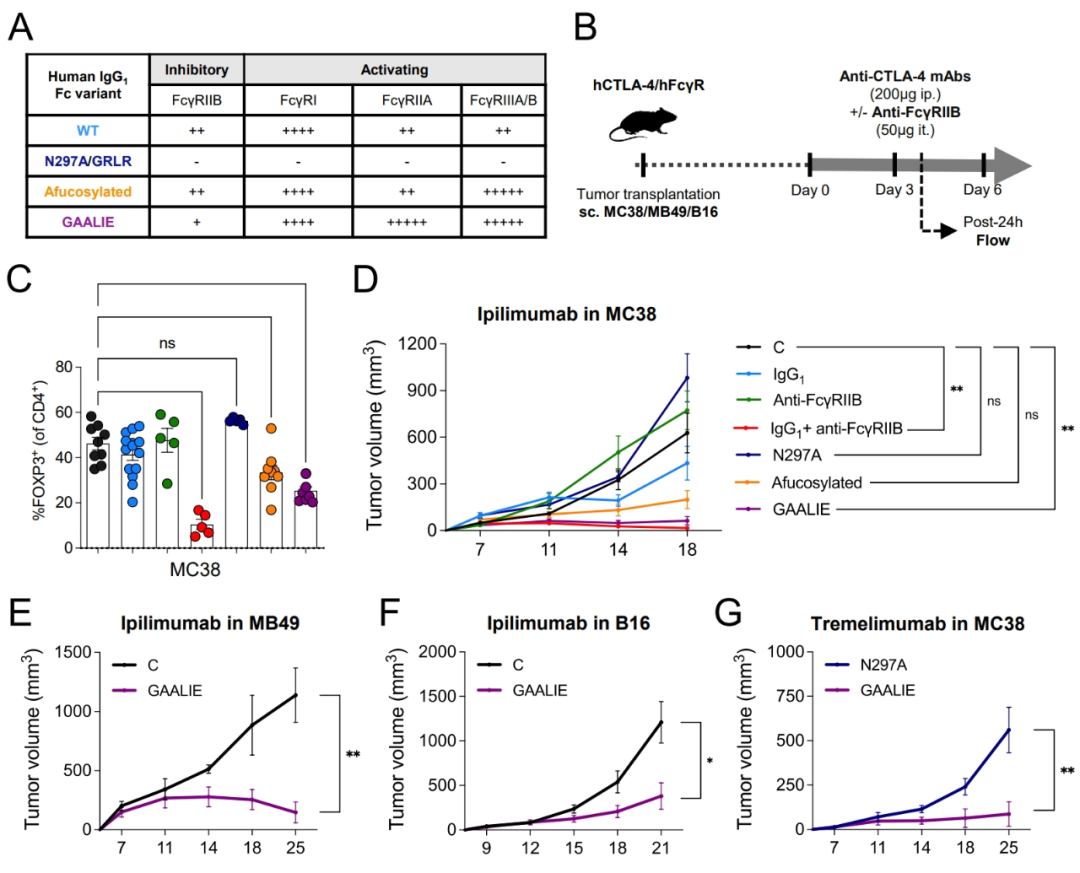
设法抑制FcγRIIB可减少调节性T细胞数量,增强抗肿瘤免疫应答
不过研究者们也清楚,FcγRIIB在人体多种免疫细胞中普遍存在,直接以它为靶标并不妥当,而现有的抗CTLA-4单抗在临床使用中副作用也比较明显,为更好地靶向FcγRIIB而改造它们的Fc段并不划算,所以研究者们的建议是以趋化因子受体CCR8作为靶标,高选择性清除肿瘤内浸润的调节性T细胞[4],尽量避免伤及无辜。
所以最后一步实验就很有意思了,研究者们发现在CTLA-4/FcγRs人源化小鼠模型身上,抗CCR8单抗要想有效抑癌,也必须经过和前面一样的Fc段改造,即对FcγRIIB的亲和力减弱、对激活性FcγRs的亲和力增强,才能有效清除调节性T细胞,调动抗肿瘤免疫应答。
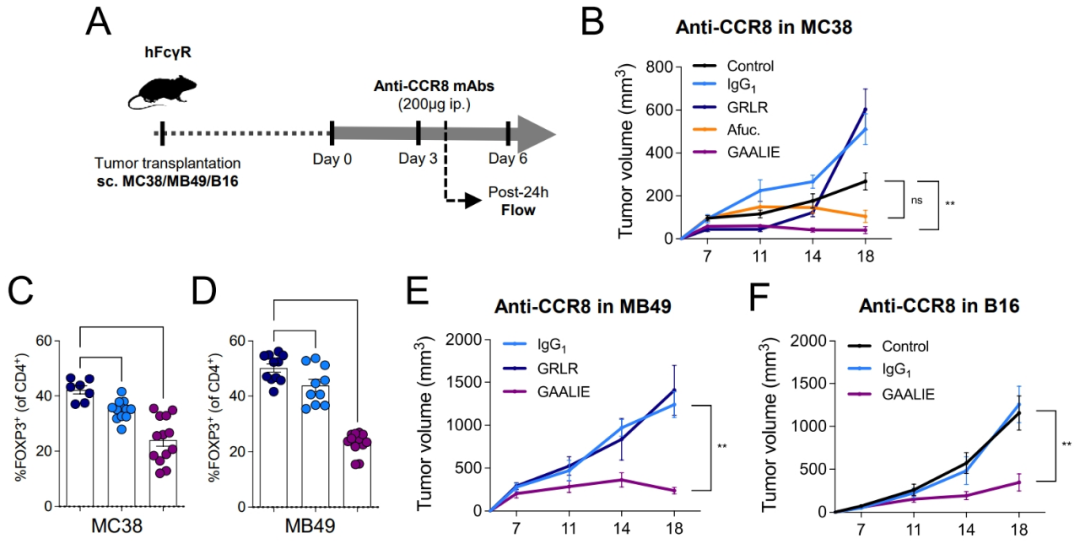
FcγRIIB还可能影响其它单抗类免疫检查点抑制剂的疗效
看来,FcγRIIB还不仅是抗CTLA-4单抗的“拦路虎”啊。虽然PD-1/L1抑制剂并不主要依赖Fc段激活ADCC/ADCP效应而起效,但后续针对其它免疫检查点开发单抗类抑制剂,尤其是靶向调节性T细胞时,可能都得留神FcγRIIB的影响,专门优化一下抗体结构了。
参考文献:
[1]Knorr D A, Blanchard L, Leidner R S, et al. FcγRIIB is an immune checkpoint limiting the activity of Treg-targeting antibodies in the tumor microenvironment[J]. Cancer Immunology Research, 2023.
[2]Vargas F A, Furness A J S, Litchfield K, et al. Fc effector function contributes to the activity of human anti-CTLA-4 antibodies[J]. Cancer Cell, 2018, 33(4): 649-663. e4.
[3]Sharma A, Subudhi S K, Blando J, et al. Anti-CTLA-4 immunotherapy does not deplete FOXP3+ regulatory T cells (Tregs) in human cancers[J]. Clinical Cancer Research, 2019, 25(4): 1233-1238.
[4]Kidani Y, Nogami W, Yasumizu Y, et al. CCR8-targeted specific depletion of clonally expanded Treg cells in tumor tissues evokes potent tumor immunity with long-lasting memory[J]. Proceedings of the National Academy of Sciences, 2022, 119(7): e2114282119.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


