研究发现小鼠肝脏敲除SRSF2引起肝癌形成的机制
来源:营养与健康所 2020-05-09 12:27
5月5日,国际学术期刊Communications Biology 在线发表了中国科学院上海营养与健康研究所冯英课题组的研究论文“Loss of SRSF2 triggers hepatic progenitor cell activation and tumor development in mice”。该研究发现小鼠肝脏特异性敲除SRSF2(
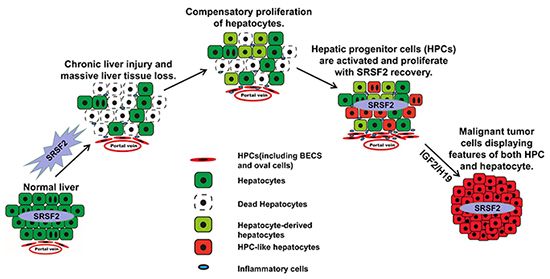
5月5日,国际学术期刊Communications Biology 在线发表了中国科学院上海营养与健康研究所冯英课题组的研究论文“Loss of SRSF2 triggers hepatic progenitor cell activation and tumor development in mice”。该研究发现小鼠肝脏特异性敲除SRSF2(HKO)能够引起肝细胞代偿性增殖和祖细胞增殖,最终出现肝细胞癌(HCC),初步揭示了HCC的形成机制。
肝脏是体内平衡的中枢器官。大多数功能由肝实质细胞(即肝细胞)完成,肝细胞约占肝脏总体积的80%。当肝脏遭受急性损伤时,肝细胞能够增殖以维持肝脏功能,该过程称为代偿性增殖。肝脏的非实质细胞包括卵圆细胞(OVs)、胆管上皮细胞(BECs)、肝星状细胞和库普弗细胞等。OVs和BECs都具备分化成肝细胞和各自细胞形态的双向潜能,所以统称为肝脏祖细胞。
冯英组此前的研究表明,小鼠肝脏中特异性敲除SRSF2基因,导致HKO小鼠在出生后一个月肝脏功能严重损害(Mol Cell Biol, 2016),说明SRSF2蛋白在小鼠肝脏发育过程中发挥重要的调控功能。进一步研究发现SRSF2蛋白在HCC病人中高表达,与肝癌的病理分级以及病人的预后之间存在着显着的相关性(Cancer Research, 2017),证明SRSF2蛋白对人类肝脏正常功能的维持也至关重要。
在研究员冯英指导下,博士生张畅通过对成年HKO小鼠模型的表型分析,发现1年左右的HKO小鼠肝脏形成了许多肿瘤,类似于HCC。SRSF2缺失引起的肝损伤导致肝脏祖细胞大量扩增,因而小鼠肿瘤细胞同时带有肝细胞和祖细胞的双重特征。肿瘤细胞中印记基因胰岛素样生长因子2(IGF2)以及H19显着升高,同时存在印迹丢失以及下游的PI3-K/AKT和MAPK/ERK信号通路被激活的现象。该研究进一步揭示了SRSF2对于小鼠成年肝脏功能维持的重要性,并为HCC的细胞来源提供了新的思路。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


