研究揭示染色质组装因子CAF-1介导核小体装配的结构基础
来源:生物物理所 2023-08-28 09:59
在真核细胞分裂过程中,染色质结构的重新建立对于维持基因组完整性和表观遗传信息传递至关重要。DNA复制一方面破坏母链DNA的亲本核小体,另一方面新生核小体必须在DNA子链上重建。染色质组装因子CAF-1
在真核细胞分裂过程中,染色质结构的重新建立对于维持基因组完整性和表观遗传信息传递至关重要。DNA复制一方面破坏母链DNA的亲本核小体,另一方面新生核小体必须在DNA子链上重建。染色质组装因子CAF-1是在进化过程中保守的异源三聚体组蛋白伴侣复合物,负责将新合成的H3-H4组蛋白装配到子链DNA上,完成从头装配的核小体组装的第一步,即形成一个由DNA缠绕H3-H4四聚体组成的核小体组装中间态Tetrasome(四聚小体)。
由于CAF-1与最基本生物学事件DNA复制高度耦联,因此缺少CAF-1的结构信息制约了科学家对核小体从头装配机制的了解。CAF-1复合物是组蛋白伴侣研究方向中公认的难题,因其主要亚基柔性很大、结合组蛋白构象不均一、分子量偏小(复合物稳定核心不到150 kDa),以至于用X射线晶体学和冷冻电镜技术来获得其高分辨率三维结构均充满挑战性。自1989年发现CAF-1至今,国际上仅报道了约30Å低分辨率的酵母Caf-1复合物负染电镜结构,无法提供相互作用细节,导致其中许多关键问题长期得不到解答。中国科学院生物物理研究所许瑞明课题组长期深耕于组蛋白伴侣的结构机理研究,先后揭示了组蛋白伴侣HJURP/DAXX特异识别组蛋白变体CENP-A/H3.3的结构机理(Genes & Development 2011; Nature Stuctural & Molecular Biology 2012),解析了Asf1调控组蛋白乙酰化修饰的分子机制(Cell 2018),阐明了双组蛋白伴侣sNASP-ASF1与Hat1乙酰化酶协同传递与修饰组蛋白的分子机理(Genes & Development 2021; Genes & Development 2022)。课题组经过十多年的摸索与优化,最终在CAF-1的结构与功能研究上取得了重要突破。
8月25日,许瑞明课题组联合李国红、朱冰课题组,在《科学》(Science)上,在线发表了题为Structural insights into histone binding and nucleosome assembly by chromatin assembly factor-1的研究长文,报道了人源染色质组装因子CAF-1、CAF-1与组蛋白H3-H4及核小体组装中间态Di-tetrasome等复合物一系列近原子分辨率三维结构,揭示了CAF-1结合组蛋白并介导右手螺旋核小体组装中间态形成的结构基础。
该研究通过CAF-1复合物不同片段组合的大量结晶条件筛选,解析了人源CAF-1复合物核心部分3.5Å的晶体结构。晶体结构显示,CAF-1三个蛋白亚基按1:1:1的方式结合,p150大亚基犹如一根柔软的绳子,两端分别缠绕住球状的p60亚基和p48小亚基。p150的ED-loop处于无序状态,CAF-1这种灵活的架构赋予了它结合组蛋白的可塑性,方便进行组蛋白的装配。体外生化实验证实CAF-1核心部分仍具有较强的结合组蛋白和组装核小体能力,但缺乏对其结合组蛋白与组装核小体分子机理的直观认识。进一步,研究通过长期的摸索与优化,发现了在CAF-1-H3-H4样品中加入30-bp的DNA片段可改善样品性质,并解析了CAF-1-H3-H4五元复合物3.5Å的冷冻电镜结构。该结构清楚地显示了一个CAF-1复合物结合一个H3-H4异源二聚体。CAF-1大亚基p150的ED-loop此时变得有序,如同一根安全带将组蛋白H3-H4牢牢绑住。对ED-loop突变体的体外生化和体内DNA复制偶联核小体组装实验数据分析表明,ED-loop的碳端对于DNA复制偶联的核小体组装至关重要。CAF-1三亚基协同作用结合组蛋白H3-H4的模式非常独特,p60挡住了H3-H4二聚体进一步形成四聚体的位置,解释了CAF-1无法直接结合H3-H4四聚体的原因。此外,30-bp DNA的加入促使部分CAF-1-H3-H4复合物形成二聚体。研究捕获到该二聚复合体4.6Å的电镜结构,发现该复合体中两个H3-H4二聚体的排列方式与H3-H4四聚体中的排列类似但不完全一样,说明DNA与CAF-1共同参与组蛋白H3-H4四聚体的形成。当加入147-bp DNA进行组装时,研究意外地获得了CAF-1结合右手螺旋Di-tetrasome这一核小体组装中间态的3.8Å的电镜结构。体外单分子磁镊实验也证实CAF-1在生理盐条件下可诱导右手螺旋核小体组装中间态的形成。这种与左手螺旋的成熟核小体NCP截然相反的手性,提示在核小体组装过程中可能存在保护性的中间步骤。
该研究厘清了CAF-1结合何种组蛋白H3-H4聚合状态的长期争议,捕获到CAF-1促进组蛋白H3-H4二聚体四聚化的中间态构象,并首次发现了CAF-1诱导右手螺旋核小体组装中间态的形成,提示了手性可能是调控核小体装配重要手段之一,刷新了人们对核小体装配过程的认知。
研究工作得到国家重点研发计划、国家自然科学基金、中国科学院战略性先导科技专项和中国科学院青年创新促进会等的资助,并获得上海同步辐射光源以及生物物理所生物成像中心和蛋白质科学平台的技术支持。
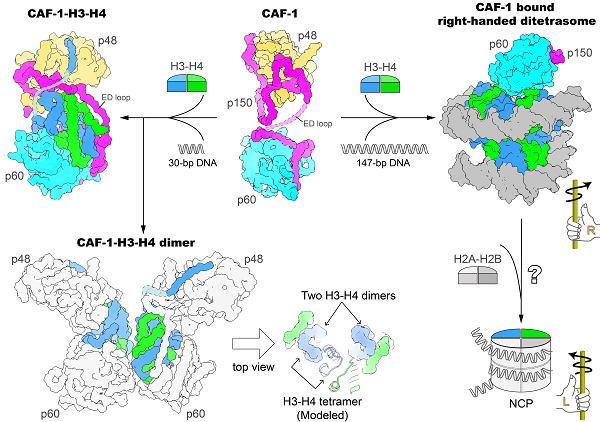
人源CAF-1结合组蛋白H3-H4并介导核小体组装的结构基础
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


