在体内原位生成CAR-T细胞,呼之欲出的in vivo CAR-T会是癌症治疗的终极答案吗?
来源:生物世界 2025-06-05 12:53
现在,越来越多的人涌入了 CAR-T 领域,每个人都想让 CAR-T 疗法更简单、更易获取,in vivo CAR-T 会是最终答案吗?
1992 年,Bruce Levine 加入了 Carl June 实验室,他们开始尝试改造免疫细胞来对抗癌症,然而,当时没有人认为他们会取得成功。如今,已是宾夕法尼亚大学教授的 Bruce Levine 回忆道:当时整个学术界都持怀疑态度,我们在学术会议上展示研究成果时,被安排在了最后一天的最后一场,还是在一个没什么人能找到的房间里。
现在,这些经过基因工程改造的免疫细胞——嵌合抗原受体 T 细胞(CAR-T 细胞),已成为治疗多种血液类癌症的最有力手段之一。此外,还有一系列临床研究显示,CAR-T 细胞疗法还对脑肿瘤、胃癌等实体瘤,以及系统性红斑狼疮等自身免疫疾病有治疗前景。据估计,CAR-T 细胞疗法今年的市场规模将达到 110 亿美元,到 2034 年将增长至 1900 亿美元。
然而,CAR-T 细胞疗法也存在着一个严重缺点——制作过程繁琐且难以施用。
简单来说,对于一个需要进行 CAR-T 细胞治疗的血液类癌症患者,需要医生从患者血液中提取 T 细胞,将其寄给制药公司,其技术人员使用慢病毒载体在这些 T 细胞表面递送并嵌入嵌合抗原受体(CAR),从而构建出 CAR-T 细胞,再将这些 CAR-T 细胞培养扩增到数亿个,然后冷冻保存、送回医院,最后输注到患者体内。整个过程复杂且繁琐,以至于在医疗发达的美国,也只有大约 200 家医疗中心能够给患者提供这种疗法。
这种繁琐的流程必然导致效率低下。对于癌症患者而言,化疗药物几乎可以立刻拿到,而 CAR-T 细胞疗法通常需要数周等待,再加上动辄数十万美元的高昂费用,患者在接受治疗前还需要先进行化疗清髓,这意味着许多本可受益于 CAR-T 细胞疗法的人最终未能接受治疗。
因此,无论是医疗人员还是患者,都希望 CAR-T 细胞疗法能够更像传统意义上的药物。
in vivo CAR-T
现在,一些前沿生物技术公司已经给出了答案——in vivo CAR-T,也就是在体内改造 T 细胞,原位生成 CAR-T 细胞。将编码嵌合抗原受体(CAR)蛋白的基因递送至血液中的 T 细胞,直接在体内生成 CAR-T 细胞,从而避免了复杂的体外基因工程改造、扩增和保存,时间和成本也将大大降低。目前,已上市的 CAR-T 细胞疗法约为 50 万美元,体内原位 CAR-T 细胞疗法有望将价格降低一个数量级。
例如,CAR-T 细胞疗法先驱 Carl June、Bruce Levine 及 mRNA 疫苗研究先驱、诺奖得主 Drew Weissman 等人创立了一家名为 Capstan Therapeutics 的公司;CRISPR 基因编辑技术先驱、诺奖得主 Jennifer Doudna 参与创立了一家名为 Azalea Therapeutics 的公司,这些公司都致力于开发 in vivo CAR-T。
实际上,随着大流行的结束,疫苗需求降低,mRNA 疫苗公司也纷纷进军 in vivo CAR-T。制药巨头们也注意到了这一趋势,通过投资、收购等方式,加入到了 in vivo CAR-T 的竞争中。例如,Capstan Therapeutics 就得到了诺华、辉瑞、拜耳、礼来、BMS 的投资;阿斯利康则在今年 3 月份以最高 10 亿美元的价格收购了 in vivo CAR-T 公司 EsoBiotec,该公司于今年 1 月启动了其首个 in vivo CAR-T 细胞疗法的人体临床试验。
虽然才刚刚进入临床阶段,但许多研究人员对这种更简单的 CAR-T 细胞疗法的潜力感到兴奋,认为这有可能挑战当前的治疗模式。
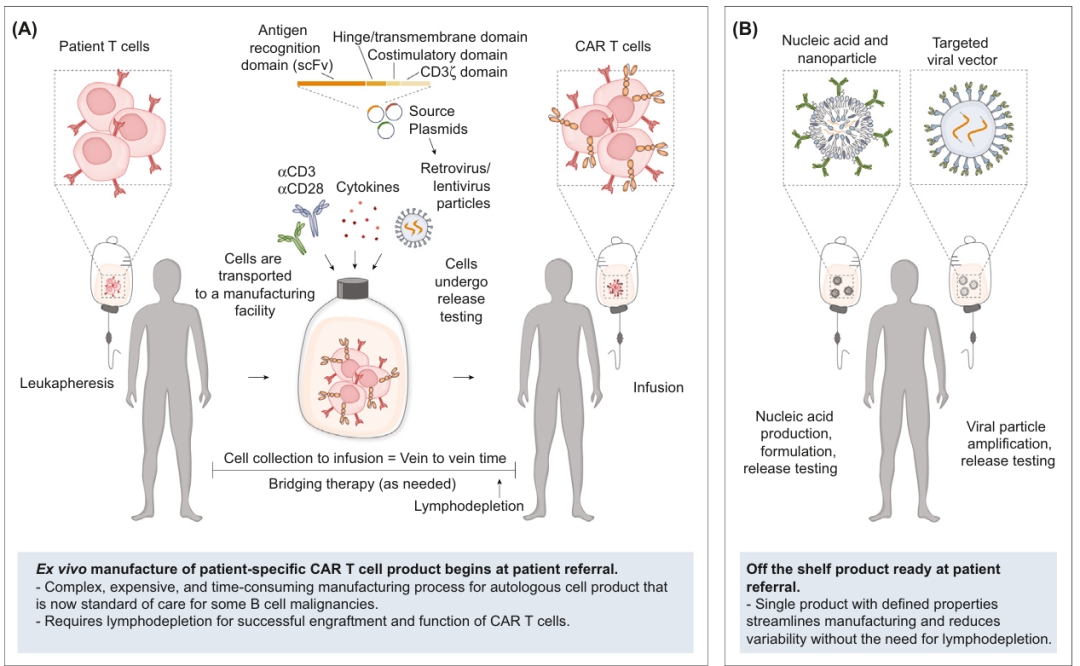
将体外疗法引入体内
以 CD19 靶向的 CAR-T 细胞疗法为例,该疗法依赖于慢病毒载体,在体外将表达 CAR 的基因整合到 T 细胞中,从而构建出能够靶向表达 CD19 的 B 细胞肿瘤。
与这些已获批的体外 CAR-T 细胞疗法(ex vivo CAR-T)类似,许多正在开发的 in vivo CAR-T 同样依赖于慢病毒载体来工程化改造 T 细胞。然而,在体外改造 T 细胞无需担心慢病毒载体将 CAR 基因导入其他细胞类型,但在体内就不一样了,研究人员必须找到能够特异性靶向 T 细胞(或者其他杀伤肿瘤的免疫细胞)的方法。
如何将 CAR 基因在正确的时间准确递送到正确的细胞、正确的位置,这是个难题。每家公司都在尝试开发解决这一难题的方法。例如——
Capstan Therapeutics 通过将抗体或抗体片段功能化到脂质纳米颗粒表面,产生靶向脂质纳米颗粒(tLNP),以实现精准递送。
Interius BioTherapeutics 公司在测试一种能附着于 CD7 蛋白的递送载体,这种蛋白质仅存在于 T 细胞和 NK 细胞表面。
Umoja Biopharma 公司在测试一种经过修饰的慢病毒载体,其表面携带了能同时靶向 T 细胞上三个受体的蛋白质,动物模型实验结果表明,这种策略比仅靶向一个受体更有效,并且能更好地模拟感染后 T 细胞自然激活时的情况。
如果上述方法行之有效,那就能够简化生产流程,让更多的患者更快地用上 CAR-T 细胞疗法,从而挽救更多生命。例如,传奇生物开发的 BCMA 靶向的 ex vivo CAR-T 细胞疗法——Carvykti,就曾出现因为产能有限,导致患者等待时间过长,其中有些患者在等到治疗之前就已去世。
除了简化生产流程外,in vivo CAR-T 还有另一个潜在优势,使用 ex vivo CAR-T 时,患者需要在输注前接受化疗,以清除体内原有的 T 细胞,为输注进来的 CAR-T 细胞的增殖腾出空间,但这一步骤会产生一些副作用(例如增加感染风险),那些身体状况太差而无不能进行的化疗的人来说,就无法进行 ex vivo CAR-T 细胞治疗。而 in vivo CAR-T 并不存在这一问题,无需进行化疗预处理,从而避免了化疗相关副作用,扩大了受益人群。
此外,ex vivo CAR-T 细胞在输注到患者体内后,容易产生一种名为细胞因子释放综合征(CRS)的炎症风暴,可能危及患者生命。而 in vivo CAR-T 可能不会出现这么严重的副作用。
即便如此,in vivo CAR-T 也有一些值得额外关注的问题,对于使用慢病毒载体构建的 CAR-T 细胞,慢病毒会将 CAR 基因永久性整合到 T 细胞基因组中,随着细胞分裂和增殖而持续存在,这对于治疗效果而言是个优势,但慢病毒在基因组中的随机整合,有引发癌症的潜在风险(虽然可能性很低),对于 ex vivo CAR-T 而言,可以很方便的筛查整合位点,而对于 in vivo CAR-T 而言,难以做到这一点。
转向更安全的 RNA
为了避免潜在风险,Capstan Therapeutics 等公司在研发中不再使用病毒载体,而是转而利用脂质纳米颗粒(LNP将 RNA 递送到 T 细胞。RNA 进入细胞质后,其遗传信息仅在短时间内用于制造 CAR 蛋白。尽管这种方法需要多次给药,但可能更安全。一旦出现严重问题的迹象,可以立即停止治疗,CAR 蛋白会在几天内或更短时间内消失。
环状 RNA(circRNA)疗法开发公司 Orna Therapeutics 则在 2024 年 5 月收购了一家 LNP 公司 ReNAgade Therapeutics,利用 LNP 递送 circRNA 在体内构建 CAR-T、CAR-NK 或 CAR-巨噬细胞。他们认为,这种方法让细胞疗法像小分子药物一样,给药一次,发挥作用,然后消失,持续给药,直到达到预期效果。
近年来,CAR-T 细胞疗法在系统性红斑狼疮等自身免疫疾病中展现了强大的治疗效果。Capstan Therapeutics 和 Orna Therapeutics 想复制这一成功,已开展 in vivo CAR-T 治疗自身免疫疾病的研究。
Myeloid Therapeutics 则是使用 LNP 递送 RNA 到包括巨噬细胞在内的髓系细胞诱导其杀伤肿瘤细胞,该公司已启动两项 in vivo CAR 临床试验,分别靶向 TROP2 和 GPC3,以治疗肺癌、乳腺癌、结肠癌和肝癌等癌症。
20 世纪 90 年代初,当研究人员开始对 T 细胞进行基因工程改造以对抗癌症时,ex vivo 方法似乎是最安全的选择。30 年过去了,ex vivo CAR-T 已经证明了自己,并且越来越受欢迎。
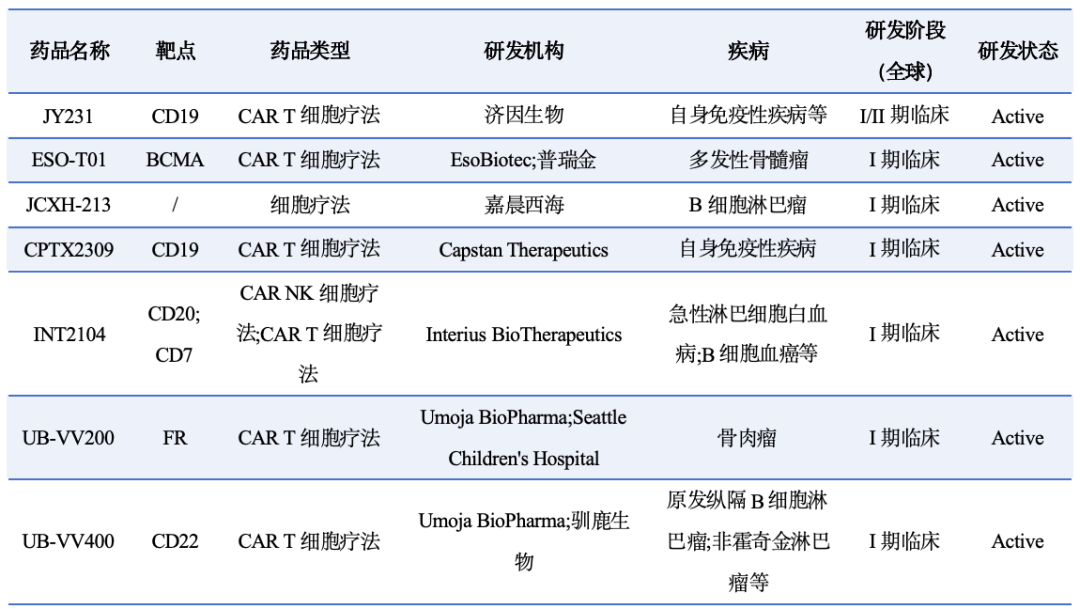
进入临床试验的 in vivo CAR-T 细胞疗法
现在,越来越多的人涌入了 CAR-T 领域,每个人都想让 CAR-T 疗法更简单、更易获取,in vivo CAR-T 会是最终答案吗?
好在,这个答案不需要等太久,目前已有几项 in vivo CAR-T 细胞疗法进入临床试验,2025 和 2026 年,这个领域将更加热闹,in vivo CAR-T 效果如何?哪种方案更有潜力?我们拭目以待。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


