Dev Cell :范衡宇实验室揭示RNA解旋酶MTR4介导的RNA监管机制决定小鼠卵母细胞体积增长的机制
来源:生物探索 2024-10-13 10:19
这一系列研究揭示了卵母细胞生长过程中的mRNA转录后加工调控和监管对于建立卵母细胞发育潜能的重要作用,为解析卵母细胞如何生长成为体内最大的细胞提供了新的理论。
成熟的卵母细胞(oocyte)是哺乳动物体内最大的细胞类型。与体细胞(somatic cell)有限的体积增长不同,卵母细胞从原始卵泡激活发育到生长完成,体积增长近500倍。但卵母细胞如何生长成为最大的细胞,还存在诸多未解之谜。卵巢中储存的原始卵泡激活以后,卵泡中的卵母细胞要经历为期数周的生长期,伴随着持续活跃的转录和转录后加工、核质运输等活动,并在卵胞质中积累了大量转录加工成熟的mRNA,为后续转录沉默的减数分裂、排卵和受精时期提供重要的物质基础【1,2】。但卵母细胞如何确保这一过程中RNA的正确加工与储存,及其对卵母细胞发育潜能的影响还尚未清晰。
2024年10月7日,浙江大学生命科学研究院范衡宇团队(博士生吴韵雯(已毕业)为本文第一作者)在Developmental Cell发表题为RNA Surveillance by the RNA Helicase MTR4 Determines Volume of Mouse Oocytes的研究论文,报道了RNA解旋酶MTR4参与的RNA外切体复合物(RNA exosome)作为一种RNA监管机制,是卵母细胞生长过程中的一个关键检查点,允许卵母细胞生长到巨大的体积,经历细胞核和细胞质的成熟并最终获得发育潜能。此外,该研究还发现了MTR4介导的RNA监管机制对于维持卵母细胞正常核环境的新功能。

研究团队在卵母细胞中首次使用细胞核与细胞质分离后进行转录组测序的方法,定量统计了卵母细胞在生长过程中整体 mRNA 水平及细胞核和细胞质这两种亚细胞组分中 mRNA 分布比例的变化,并鉴定出细胞核和细胞质中转录物的不同剪接加工特征,提出 RNA 监管机制可能在其中发挥重要功能。通过对 RNA 外切体复合物的前期调研,该研究采用在卵母细胞中条件性敲除 Mtr4 这一基因来实现对卵母细胞中RNA监管机制的破坏。基于基因敲除鼠的表型分析和回补实验证实了MTR4缺失会给小鼠卵母细胞造成无法逆转的严重的成熟障碍,包括卵母细胞体积明显减小,无法完成卵子成熟所必须的核构象转变、基因组转录沉默和减数分裂恢复。
通过荧光原位杂交实验和核质分离测序等实验,该研究证明了 MTR4 缺失后 RNA 监管机制失效,导致大量未成熟RNA滞留在细胞核中,与此同时细胞质中的成熟mRNA 储量也大幅下降。生信分析表明,MTR4 缺失后核中滞留的转录本多为加工不完全的废物 RNA,部分内含子异常保留的转录本甚至被进一步运输到胞质中。通过在 Mtr4 敲除的卵母细胞中显微注射回补 MTR4,检测到异常累积的转录本含量明显减少,证实了 MTR4 介导的 RNA 监管机制在监管 RNA质量和维持 RNA 正常的核质分布比例中发挥直接作用。
Mtr4敲除小鼠卵母细胞RNA 监管机制失效后,卵母细胞发育过程中核构象由NSN向SN转变失败。通过进一步的表型鉴定及染色质开放性分析(ATAC-seq),发现核中异常累积的RNA造成了染色质开放程度增加,染色质无法正常凝集并转录沉默;CUT&Tag测序分析也揭示了与转录密切相关的组蛋白修饰H3K4me3在染色质上分布异常。除影响染色质结构外,核中异常累积的RNA还造成了细胞核区室化结构的异常,包括核斑点和核仁无法正常组装。以上实验结果揭示了MTR4 介导的RNA 监管机制在维持卵母细胞健康的核环境及促进细胞核成熟方面的重要功能,也进一步发现RNA稳态负反馈调节染色质构象、组蛋白修饰建立和核内区室化结构的形成。
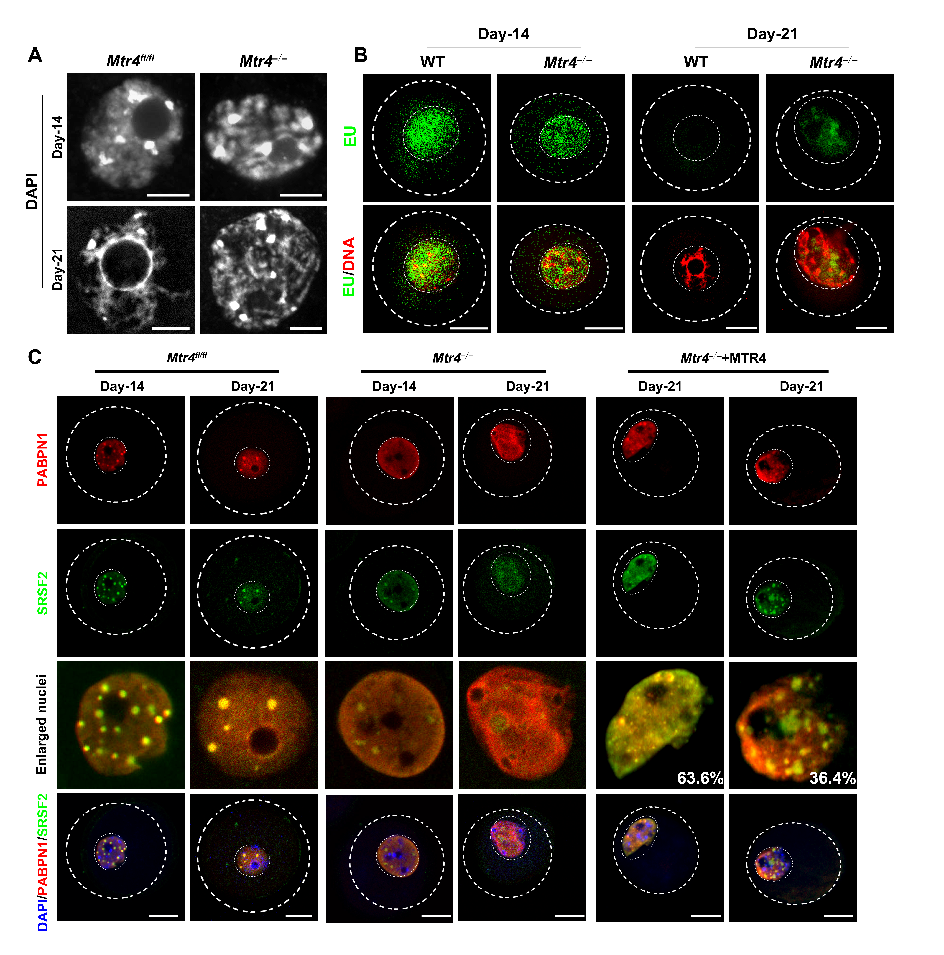
图1: RNA监管机制失效后卵母细胞的细胞核环境紊乱。A: MTR4缺失后卵母细胞核构象由NSN向SN转变失败。B: MTR4缺失后卵母细胞无法转录沉默。C: MTR4缺失后PABPN1介导的NPAD结构和nuclear speckles无法正常形成(Credit: Developmental Cell)
此外,该研究还提出RNA 监管机制通过以下两个方面影响卵母细胞的生长和胞质成熟。(1)维持健康的核环境,保证了卵母细胞生长过程中的转录及转录后加工活动,在胞质中累积足量的正常转录本。(2)保证了核仁正常的组装与功能,为细胞质的蛋白翻译提供核糖体机器。综上,MTR4介导的RNA监管机制确保了细胞核和细胞质中丰富的mRNA积累和有序储存,对于决定卵母细胞的体积和发育潜能具有重要生理意义。
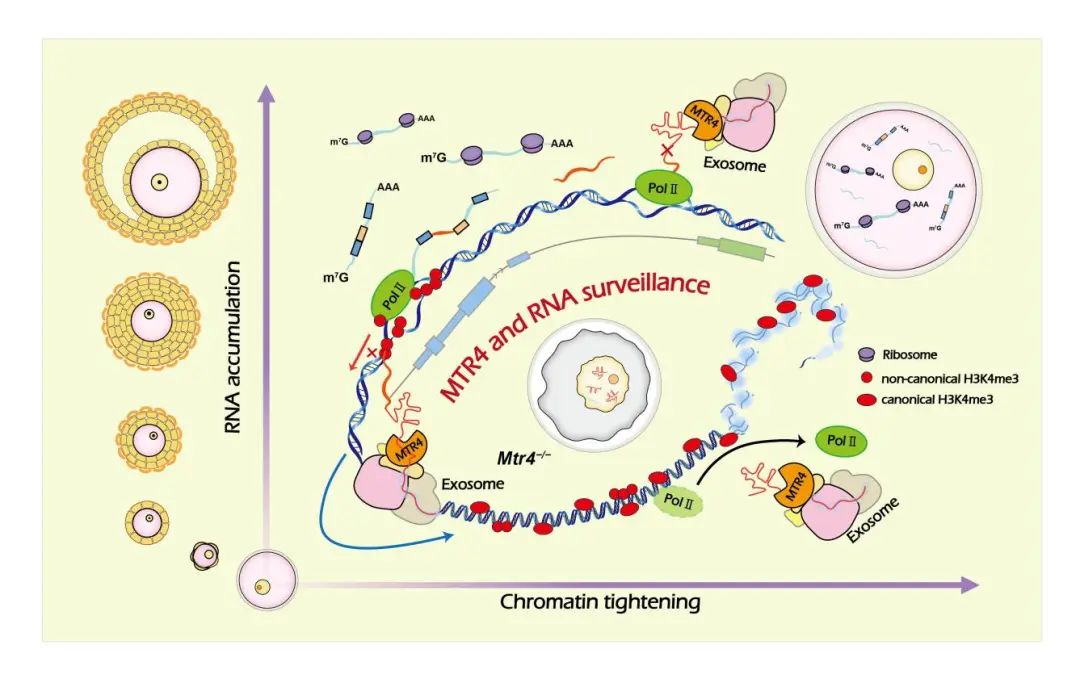
图2: RNA监管机制确保小鼠卵母细胞生长成熟的模式图(Credit: Developmental Cell)
该课题组在先前的研究中发现,Poly(A)结合蛋白PABPN1具有对新生RNA进行剪切、加尾、保护和储存的重要功能【3】。PABPN1通过介导液-液相分离形成细胞核内的特定功能区域nuclear poly(A) domain (NPAD),调控卵子发生过程中mRNA的转录后加工。MTR4和PABPN1同属于RNA外切体复合物,两者的敲除小鼠卵母细胞在分子水平上均存在RNA加工异常、不能有效建立起母源mRNA储备等问题,并具有卵母细胞体积减小、发育成熟障碍等相似的表型。
这一系列研究揭示了卵母细胞生长过程中的mRNA转录后加工调控和监管对于建立卵母细胞发育潜能的重要作用,为解析卵母细胞如何生长成为体内最大的细胞提供了新的理论。
参考文献:
1. Rong, Y., Ji, S.Y., Zhu, Y.Z., Wu, Y.W., Shen, L., and Fan, H.Y. (2019). ZAR1 and ZAR2 are required for oocyte meiotic maturation by regulating the maternal transcriptome and mRNA translational activation. Nucleic Acids Res 47, 11387-11402. 10.1093/nar/gkz863.
2. Cheng, S.Y., Altmeppen, G., So, C., Welp, L.M., Penir, S., Ruhwedel, T., Menelaou, K., Harasimov, K., Stützer, A., Blayney, M., et al. (2022). Mammalian oocytes store mRNAs in a mitochondria-associated membraneless compartment. Science 378. ARTN eabq4835 97210.1126/science.abq4835.
3. Dai, X.X., Pi, S.B., Zhao, L.W., Wu, Y.W., Shen, J.L., Zhang, S.Y., Sha, Q.Q., and Fan, H.Y. (2022). PABPN1 functions as a hub in the assembly of nuclear poly(A) domains that are essential for mouse oocyte development. Sci Adv 8. 10.1126/sciadv.abn9016.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


