Nature重磅:全世界第七个治愈的艾滋病患者出现,为更广泛患者群体带来新希望
来源:生物世界 2025-12-03 14:15
研究团队为抗逆转录病毒疗法(ART)的替代疗法指明了方向,阐明了抗体疗法如何与强大的细胞免疫反应协同作用,从而在不使用抗逆转录病毒疗法(ART)的情况下实现对 HIV 病毒的控制。
艾滋病(AIDS)是获得性免疫缺陷综合征的简称,由感染 HIV 病毒引起。HIV 是一种能攻击人体免疫系统的病毒,它把人体免疫系统中重要的 CD4+ T 细胞作为主要攻击目标,大量破坏该细胞,经过数年、甚至长达十年或更长的潜伏期后发展成艾滋病病人,使人体丧失免疫功能,因抵抗力极度下降会出现多种感染,后期常常发生恶性肿瘤,以至全身衰竭而死亡。
据估计,自艾滋病流行以来,全世界累计感染患者高达 8800万,造成了数千万人死亡。然而,起劲仍未研发出有效的艾滋病疫苗,现有的抗逆转录病毒药物(ART)也只能抑制病毒,不能清除 HIV 病毒或治愈艾滋病。
迄今为止,全世界只有 6 位艾滋病患者被宣布“治愈”,分别是——分别是“柏林病人”、“伦敦病人”、“杜塞尔多夫病人”、“纽约病人”、“希望之城病人”和“日内瓦病人”。
早在 1996 年,邓宏魁等人发现了 CCR5 是 HIV-1 病毒入侵人类 T 细胞的主要受体。有极少数人因为携带了罕见的 CCR5 Δ32/Δ32 基因纯合突变,导致不会感染艾滋病。长期以来,携带 CCR5 Δ32/Δ32 基因纯合突变的干细胞移植所带来的 HIV-1 抗性,被认为是实现艾滋病治愈的主要机制,实际上,前五位被治愈的艾滋病患者,都是接受了携带 CCR5 Δ32/Δ32 基因纯合突变的干细胞移植。
然而,第六位治愈者所移植的干细胞并未携带 CCR5 基因突变,因此,可能存在着一种不依赖 CCR5 的机制,同样能够实现艾滋病的治愈。
2025 年 12 月 1 日,德国柏林夏里特医学院的研究人员在国际顶尖学术期刊 Nature 上发表了题为:Sustained HIV-1 remission after heterozygous CCR5Δ32 stem cell transplantation 的研究论文。
该研究报道了第七位“治愈”的艾滋病患者,这是一名 60 岁的柏林男性(因此被称为柏林患者2号,简称 B2),他于 2009 年确诊 HIV-1 感染,2015 年发展为急性髓系白血病,由于未能找到配型的携带 CCR5 Δ32/Δ32 纯合突变的供体,医生给他进行了同种异体干细胞移植,这些干细胞携带 CCR5 Δ32 杂合突变(也就是还有一个拷贝的 CCR5 正常),该患者在干细胞移植三年后(2018 年)停用抗逆转录病毒疗法,至今已超过七年时间,仍未发现 HIV-1 病毒复制的迹象。

实际上,该患者自身也携带了 CCR5 Δ32 杂合突变,但他仍然感染了 HIV-1 病毒。2015 年,他的病情加重后,并被诊断出患上了急性髓系白血病。医生为他找到了配型的干细胞供体,但该供体也只携带 CCR5 Δ32 杂合突变。
2015 年第,该患者接受了干细胞移植,治疗后病情好转。2018 年,他不顾医嘱停止了抗逆转录病毒治疗,迄今已维持 HIV 缓解超过七年时间(七年零三个月),血浆中未检测到 HIV RNA,病毒库分析显示,患者在干细胞移植前存在完整的前病毒 HIV,但移植后在血液或肠道组织中未检测到具有复制能力的 HIV 病毒。HIV 特异性抗体和 T 细胞反应的减弱或消失支持了 HIV 病毒活性缺失的结论。干细胞移植时的高抗体依赖的细胞毒作用(ADCC)可能促进了对 HIV 病毒库的清除。
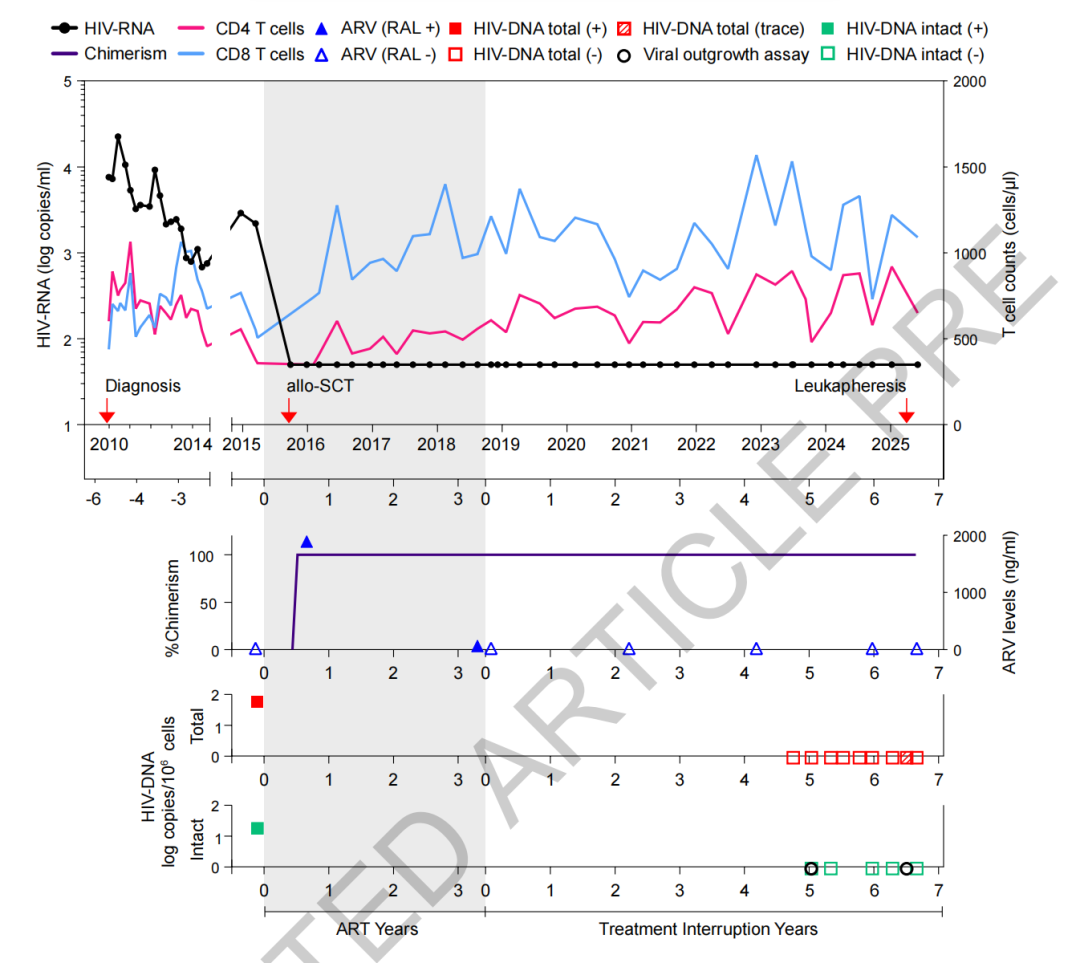
这项研究连同“日内瓦病人”的案例,进一步证明了 CCR5 Δ32/Δ32 纯合突变介导的对 HIV 病毒的抗性,并非实现艾滋病持久缓解的必要条件,CCR5 不突变或杂合突变的干细胞移植,同样能够帮助艾滋病患者获得持久缓解,这也意味着,具有清除 HIV 潜力的干细胞供体人群可能比此前预想的更为广泛。
值得一提的是,Nature 期刊同期还发表了两篇关于艾滋病治疗的研究论文。


自 20 世纪 80 年代末问世以来,抗逆转录病毒疗法(ART)已拯救了成百上千万艾滋病患者的生命,将艾滋病从一种致命疾病转变为一种可长期控制的慢性疾病。尽管取得了这些成就,但抗逆转录病毒疗法(ART)并非治愈手段,而且即便经过数十年的治疗,一旦停止治疗,几乎所有患者体内的 HIV 病毒都会迅速反弹。
在这两项研究中,研究团队为抗逆转录病毒疗法(ART)的替代疗法指明了方向,阐明了抗体疗法如何与强大的细胞免疫反应协同作用,从而在不使用抗逆转录病毒疗法(ART)的情况下实现对 HIV 病毒的控制。
David Collins 团队分析了之前报道的四项广谱中和抗 HIV-1 抗体(bNAb)治疗艾滋病的临床试验,系统绘制了 CD8+ T 细胞对自体 HIV 表位的应答图谱。,揭示了与干预后实现 HIV 病毒控制及 HIV 特异性 CD8+ T 细胞干性相关的分子特征,包括代谢适应性特征和 T 细胞耗竭程度的减轻。这些发现明确了先于 HIV 病毒控制出现的免疫特征标志,为开发能够诱导持久 HIV 缓解的联合免疫疗法提供了重要理论依据。
R. L. Rutishauser 和 Steven Deeks 团队分析了接受联合免疫疗法(疫苗+抗体+免疫佐剂)后实现 HIV 病毒控制的个体,揭示了与 HIV 病毒控制相关的免疫特征,表明了对 HIV 病毒的控制不单纯依赖于 bNAb,还在于成功激活了患者自身的 CD8+ T 细胞免疫反应,延缓了 HIV 病毒的反弹,有望实现对 HIV 病毒的持续控制。
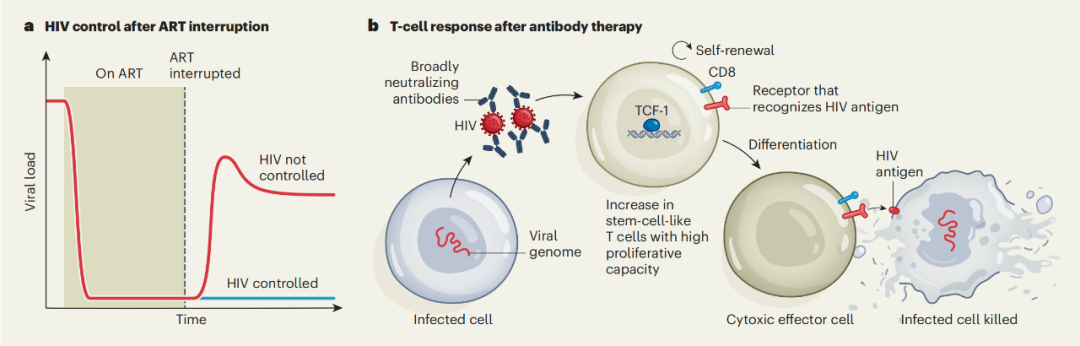
这两项独立研究取得了趋同的结果,提示了我们或许难以通过单一的“灵丹妙药”来实现不依赖抗逆转录病毒疗法(ART)的 HIV 病毒控制,而是通过一种协调一致的免疫策略——强化人体自身的防御机制来抑制 HIV 病毒。广泛中和抗体(bNAb)、强大的 CD8+ T 细胞反应,以及其他正在开发的针对 HIV 病毒和免疫系统的潜在策略之间的协同作用,为实现无需每日服药即可控制艾滋病病毒提供了路线图。
2007 年,“柏林病人”的出现,首次证明了艾滋病是可以治愈的,而现在,这两项新研究表明,一条可扩展的、基于免疫的无需抗逆转录病毒疗法的艾滋病缓解之路,逐渐清晰可见。
论文链接:
1. https://www.nature.com/articles/s41586-025-09893-0
2. https://www.nature.com/articles/s41586-025-09932-w
3. https://www.nature.com/articles/s41586-025-09929-5
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


