盘点|细胞疗法对多种疾病安全有效,细胞时代已经到来?
来源:生物谷 2022-08-24 09:24
随着细胞免疫治疗的蓬勃发展和临床试验的井喷,各种新兴的细胞药物给肿瘤治疗领域带来了质的飞跃。
随着细胞免疫治疗的蓬勃发展和临床试验的井喷,各种新兴的细胞药物给肿瘤治疗领域带来了质的飞跃。截止2022年4月15日,全球肿瘤免疫治疗在研管线中有2756种细胞治疗药物,相比2021年的2031种细胞疗法药物,有36%的增长。
今天,生物谷就对近期科学家们在相关研究领域取得的新进展进行整理,分享给大家!
【1】Cancer Discov:构建单细胞框架,有可能改善CAR-T细胞疗法
doi:10.1158/2159-8290.CD-21-1508
在一项新的研究中,来自美国圣犹大儿童研究医院的研究人员证实在某些情况下,可以在治疗前预测杀死癌症的嵌合抗原受体(CAR)T细胞(CAR-T)的长期表现。该研究提供了一个独特的基于细胞测序的框架来衡量和改善CAR-T细胞免疫疗法的性能。相关研究结果于2022年7月6日在线发表在Cancer Discovery期刊上。

CAR-T细胞通过利用患者的免疫系统识别和杀死癌细胞而发挥作用。这种免疫疗法已被证明对治疗儿童和成人白血病和淋巴瘤有效,但该疗法有时会失败或随着时间推移而减弱。研究人员利用实验室中的先进技术,在准备用于治疗的全部CAR-T细胞中,发现了一小部分CAR-T细胞在输注给急性淋巴细胞白血病(ALL)患儿时产生了大部分持久的抗癌活性。他们创建的这种方法框架可作为改进其他CAR-T细胞疗法的模板,为驾驭这些免疫疗法的复杂性提供指导。
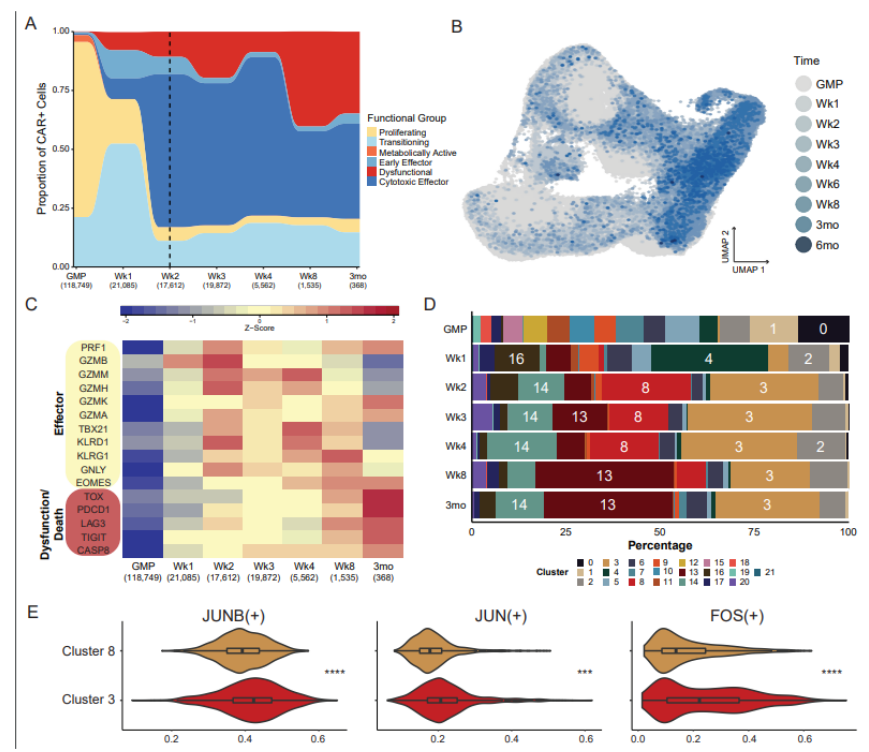
随着时间的推移,效应基因和功能失调基因的表达与CAR-T细胞亚群的动力学相关。
研究者Paul Thomas博士说:“这是一个令人惊讶的发现。似乎是输注前CAR-T细胞产品中的少数细胞实际上对患者的抗肿瘤反应有贡献。”
【2】Diabetologia:干细胞疗法或能保护癌症患者机体抵御癌症疗法所产生的严重副作用
doi:10.1007/s00125-022-05708-3
目前免疫检查点抑制剂已被广泛用于治疗多种类型癌症,然而,其所引发的一种严重副作用就是1型糖尿病。近日,一篇发表在国际杂志Diabetologia上题为“Human adipose-derived mesenchymal stem cells prevent type 1 diabetes induced by immune checkpoint blockade”的研究报告中,来自日本大阪大学等机构的科学家们通过研究发现,干细胞疗法或能保护机体抵御诸如上述严重副作用的发生。
抑制PD-1/PD-L1之间的相互作用或许会引发机体免疫系统发生多种改变,最明显的是会导致胰腺中朗格汉斯岛中免疫细胞(尤其是巨噬细胞)的大量积累,从而干扰胰岛素的产生。
研究人员通过给予小鼠纯化的PD-L1单克隆抗体,通常不会造成1型糖尿病,随后他们向小鼠注射人类脂肪细胞衍生的MSCs并分析胰腺分泌物中的免疫细胞。结果发现,利用抗PD-L1抗体抑制PD-1/PD-L1之间的相互作用或许会使得小鼠模型的糖尿病发病率为64%,而给予小鼠模型MSCs时其发病率则为19%。进一步研究结果表明,MSCs可能是通过诸如外泌体等因子保护胰腺细胞抵御免疫系统的攻击。
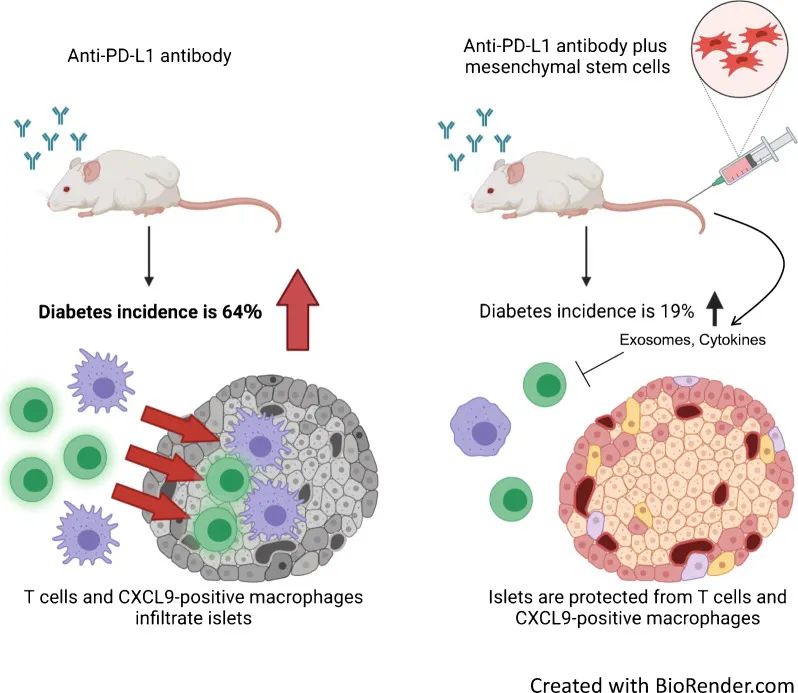
综上,该研究证实了MSC的移植疗法或能有效预防与免疫检查点癌症疗法相关的糖尿病的发生,因此其或许有望作为一种新型的辅助细胞疗法从而帮助改善癌症患者的生活质量。
【3】Nat Commun:新型免疫增强疗法或能增强CAR-T细胞疗法来治疗人类血液癌症
doi:10.1038/s41467-022-30860-0
刺激遗传修饰的T细胞来攻击癌细胞的细胞免疫疗法的进展如今已经彻底改变了特定血液癌症的疗法,目前FDA已经批准了6种诸如此类的CAR-T细胞疗法来治疗特定类型的白血病、淋巴瘤和多种黑色素瘤。然而,一些患者机体的肿瘤对这些疗法并没有反应,而且很多最初表现良好的患者后来出现了癌症的复发。
近日,一篇发表在国际杂志Nature Communications上题为“A long-acting interleukin-7, rhIL-7-hyFc, enhances CAR-T cells expansion, persistence and anti-tumor activity”的研究报告中,来自华盛顿大学医学院等机构的科学家们通过研究发现,当输注了这些遗传修饰的T细胞后,利用一种名为白介素7(IL-7)的免疫增强蛋白的额外疗法或许会促进抗癌CAR-T细胞数量增加并能更加有效地杀灭肿瘤细胞。

这项研究报告中,研究人员进行的临床试验调查了一种长效的遗传修饰的IL-7与靶向作用CD19(一种B细胞抗原)的CAR-T细胞疗法一起用于治疗复发性或难治性弥漫性大B细胞淋巴瘤(DLBCL)患者的效果。
医学博士John F. DiPersio说道,很多研究人员正在尝试利用不同的策略来增强CAR-T细胞治疗血液癌症的功能,研究人员对IL-7非常感兴趣,因为他们知道IL-7是T细胞扩张的一种主要的驱动子,当机体患病时,其就会制造IL-7来增加T细胞的数量,当在CAR-T细胞疗法后给予携带肿瘤的免疫缺陷小鼠一种长效作用的IL-7后,研究人员观察到这些CAR-T细胞相比未接受IL-7的小鼠而言会扩张一万多倍,这些CAR-T细胞也会持续更长时间,且会明显增加机体的抗肿瘤活性。
【4】J Neurosci:新型干细胞疗法或有望治疗人类脊髓损伤
doi:10.1523/JNEUROSCI.2177-21.2022
创伤性脊髓损伤 (SCI,traumatic spinal cord injury)是一种导致年轻人永久性神经系统残疾的主要原因。近日,一篇发表在国际杂志The Journal of Neuroscience上的研究报告中,来自曼尼托巴大学等机构的科学家们通过研究开发了一种基于干细胞的疗法,其或有望帮助开发治疗人类脊髓损伤的新型再生疗法。

研究人员发现,受损脊髓组织中存在一类抑制性分子,其或会潜在限制干细胞移植的成功率,当在移植阶段治疗性地阻断这些分子的功能时,这种疗法或许就会导致干细胞生存率的增加,并能在受损的脊髓中产生合适的神经细胞,而这是当前干细胞疗法开发所面临的重大挑战,而研究人员所提出的这一策略或许能让大鼠在行走时获得更多的重量支撑和协调能力。
【5】Nat Commun:基于细胞疗法治疗糖尿病的新突破
doi:10.1038/s41467-022-29588-8
血糖平衡主要由胰腺 "朗格汉斯岛 "调节,它是由几种类型的内分泌细胞组成。这些胰岛的大部分是由α-和β-细胞组成的,在血糖水平变化时分别释放胰高血糖素和胰岛素来定义。产生具有稳定功能身份的替代细胞对于开发基于细胞的疗法至关重要。生产胰岛素分泌替代细胞以治疗糖尿病的努力需要可靠的工具来评估胰岛细胞身份。为了更全面地了解定义细胞类型身份的因素,目前,基因组分析工具已被证明是一种非常有价值的定义细胞身份的工具。
近日,来自瑞士日内瓦大学的研究学者在Nat Commun上发表了一篇题为“Generation of human islet cell type-specific identity genesets”,通过一个共同的标准化管道来定义了不同类型的胰岛细胞的转录组特征谱。

在该研究中,研究人员进行了一项元分析,研究了7个已发表的人类胰岛单细胞转录组数据集(共54个供体)的单体激素α、β、γ和δ细胞的硅纯化群体,生成了细胞类型的特定基因组,探索了基于最终细胞类型分配的整体胰岛组成,获得了人胰腺中GCG / INS双激素细胞的转录组学特征。接下来,利用成对比较的方式将每种胰岛细胞类型直接与其他细胞类型进行比较,定义了人类胰腺α、β、γ和δ细胞的身份基因。
为了定义胰岛中不太常见的细胞类型,他们生成了一个包含人类胰岛单细胞转录组图谱的数据集,这些胰岛富集了γ,δ和ε细胞组分。该数据集为不太常见的人类胰岛细胞类型提供了不寻常的表征,并称为 γδε丰富数据集。随后,他们根据整合来自七个已发表数据集的差异表达而产生的身份基因,生成了最佳基因集,准确定义了胰岛细胞类型特异性身份。
对数据集评估后发现,该胰岛细胞类型特异性基因组在综合灵敏度和特异性方面的表现优于先前发表的细胞类型特异性身份基因列表,且该基因组在受控条件下的GSEA分析从未失败,这与Lawlor和Xin数据集中的γ和δ细胞身份基因组不同,后者在所有条件下都失败了。最后,他们发现,胰岛细胞类型特异性基因组有助于评估和表征分化、转化和疾病期间胰岛细胞特性的动态变化。
【6】Science子刊:将溶瘤病毒与CAR-T细胞疗法相结合可改善对实体瘤的治疗
doi:10.1126/scitranslmed.abn2231
在一项新的研究中,来自梅奥诊所的研究人员设计了一种将嵌合抗原受体(CAR)T细胞(CAR-T)疗法与一种溶瘤病毒相结合的免疫治疗技术,更有效地靶向和治疗实体瘤。相关研究结果发表在2022年4月13日的Science Translational Medicine期刊上。

这种组合疗法涉及将一种溶瘤病毒加载到经基因改造后寻找癌细胞表面抗原的CAR-T细胞中。作为天然存在的病毒,溶瘤病毒可以感染和分解癌细胞。它们或者在癌细胞中天然复制得很好,或者可以经过改造后选择性地靶向癌细胞。这项新的研究表明CAR-T细胞可以将溶瘤病毒递送到实体瘤中。然后,溶瘤病毒可以渗透到肿瘤细胞中,进行复制,使肿瘤细胞爆裂开,并刺激一种强大的免疫反应。
论文通讯作者、梅奥诊所癌症中心基因与病毒治疗项目共同负责人Richard Vile博士解释说:“这种方法允许肿瘤被溶瘤病毒和CAR-T细胞杀死。此外,当溶瘤病毒被递送时,它将肿瘤变成一个极具炎症性的环境,然后患者自身的免疫系统会看到并开始攻击。”
【7】Nat Aging:细胞再生疗法可以安全地逆转小鼠衰老
doi:10.1038/s43587-022-00183-2
在一项新的研究中,来自美国沙克生物研究所和Genentech公司的研究人员证实他们可以通过将中老年小鼠的细胞部分地重置到更年轻的状态,安全有效地逆转它们的衰老过程。相关研究结果于2022年3月7日在线发表在Nature Aging期刊上,论文标题为“In vivo partial reprogramming alters age-associated molecular changes during physiological aging in mice”。
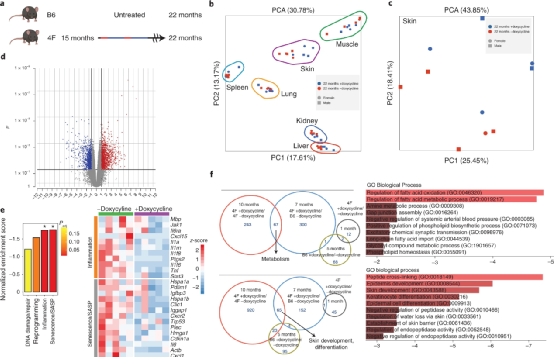
转录组分析:长期部分重编程小鼠(15个月+7个月多西环素诱导)vs 对照组
研究者总结道,相比于短期部分重编程,由OSKM(Oct4, Sox2, Klf4 与c-Myc)因子介导的长期部分重编程才是真正能起到抗衰老、年轻化效果的治疗手段。然而,为何在全身诱导OSKM却只能在部分器官中得到响应,以及从DNA甲基化水平的逆转如何传递到代谢组水平的变化,最后得到年轻化效果,还有待于进一步研究。
有趣的是,研究者还指出,对OSKM因子的响应具有性别差异。在本研究中发现,雌性小鼠的皮肤组织中OSKM介导的年轻化效应比在雄性小鼠中的更明显。对该现象的进一步解释有助于人们开发新一代的延缓衰老以及年轻化的治疗方法。
【8】Nat Med:2期临床试验表明CAR-T细胞疗法axi-cel有效治疗高危大B细胞淋巴瘤
doi:10.1038/s41591-022-01731-4
在一项名为ZUMA-12的2期、多中心、单臂临床试验中,来自美国德克萨斯大学MD安德森癌症中心等研究机构的研究人员发现基于嵌合抗原受体(CAR)T细胞疗法axicabtagene ciloleucel(axi-cel)的一线治疗在高危大B细胞淋巴瘤(LBCL)患者中取得了较高的完全缓解率。
相关研究结果于2022年3月21日在线发表在Nature Medicine期刊上,论文标题为“Axicabtagene ciloleucel as first-line therapy in high-risk large B-cell lymphoma:the phase 2 ZUMA-12 trial”。这项研究由吉利德公司旗下的Kite Pharma资助。
在接受axi-cel治疗的40名患者中,89%出现客观缓解,78%出现完全反应。12个月的估计总生存率为91%。在数据截止点,中位随访15.9个月后,73%的患者有持续缓解。虽然中位缓解期、无事件生存期和无进展生存期未达到,但是12个月的估计值分别为81%、73%和75%。
论文通讯作者、德克萨斯大学MD安德森癌症中心淋巴瘤与骨髓瘤教授Sattva Neelapu博士说,“现有的LBCL治疗方法包括六个月的化疗。这些新的研究结果提供了证据表明axi-cel可能在一次治疗中提供有效的反应,并消除患者接受其他疗法的需要。”
【9】重磅!科学家进行全球脊髓损伤干细胞疗法临床试验!
新闻阅读:Japan team carries out world-first spinal cord stem cell trial
近日,来自日本庆应义塾大学的科学家们表示,他们已经成功将干细胞移植到了一名脊髓损伤的患者机体中,而这是科学家们在全球进行了首例此类临床试验。目前并没有有效的疗法来治疗因严重脊髓损伤所致的瘫痪,脊髓损伤仅在日本就影响着超过10万人的健康。
为此,研究人员就想通过研究来阐明是否利用诱导多能干细胞就能帮助治疗脊髓损伤,诱导多能干细胞是通过刺激成熟的、专业的细胞回归到幼年状态而产生的;随后研究人员能诱导其成熟为不同类型的细胞,本文研究中,研究人员就使用了诱导多能干细胞所衍生的神经干细胞。
该临床试验的第一步是将超过200万个诱导多能干细胞衍生的细胞注射到上个月进行手术的患者的脊髓中,研究者Masaya Nakamura表示,这或许是一项巨大的进步,在该疗法投入使用之前我们还有许多工作需要完成;而该研究的初始阶段旨在证实这种干细胞移植策略的安全性。
进行这项临床试验的患者将会由一个独立的委员会进行为期三个月的监测,从而决定是否该研究能够安全地继续进行,以及其他患者是否也能接受干细胞的移植;目前研究人员希望能观察到是否干细胞的移植能够改善患者的神经性功能和生活质量。本文研究人员在2019年获得了政府对该试验的批准,但由于COVID-19疫情影响,受试者的招募工作暂时被搁置了。
【10】Mol Cancer Therap:科学家发现一种CAR-T细胞疗法治疗人类实体瘤的新型潜在靶点
doi:10.1158/1535-7163.MCT-21-0872
目前,嵌合抗原受体T细胞疗法(CAR-T)已经在治疗特定血液癌症上取得了重大成就,使得患复发性/难治性疾病的患者能够存活更长时间且变得更加健康,但在临床研究中,细胞疗法实际上并未成功治疗实体瘤患者,部分原因是缺乏在重要组织中未表达的肿瘤靶点。
近日,一篇发表在国际杂志Molecular Cancer Therapeutics上题为“Olfactory Receptor OR2H1 is an effective target for CAR T cells in human epithelial tumors”的研究报告中,来自Moffitt癌症研究中心等机构的科学家们识别出了一种名为OR2H1的CAR-T细胞新型潜在靶点,其或有望帮助抑制肺癌和卵巢癌的生长。
CAR-T细胞疗法的关键在于对患者机体的T细胞进行遗传修饰,这些细胞能通过一种名为血浆分离置换法(apheresis)的过程进行收集,随后并运送到实验室中,在实验室中细胞就会被修饰从而含有能识别癌细胞表面特殊标志物的T细胞受体,这种新修饰的T细胞(CAR-T细胞)在输注回患者机体之前会被刺激进行生长和繁殖,而CAR-T细胞表面的受体能充当GPS的角色,寻找癌细胞表面的特殊标志物;目前已经有多种CAR-T细胞疗法获批用于治疗白血病、淋巴瘤和多发性骨髓瘤患者,但目前并没有获批用于治疗实体瘤的CAR-T细胞疗法。
目前研究人员正在努力研究识别肿瘤生物标志物,从而促进CAR-T细胞疗法更加有效地治疗实体瘤,研究者的目标就是寻找一种能在肿瘤细胞中表达但并不在正常细胞中进行表达的标志物,从而来减少潜在的不必要的副作用的出现;研究者Jose Conejo-Garcia表示,我们重点研究了名为嗅觉受体的蛋白家族,其会在鼻腔中进行表达,并促进嗅觉感知;在实验期间,研究者发现,OR2H1蛋白还会在多种实体瘤中进行表达,包括4%的肠癌样本到69%的胆囊癌样本等。重要的是,在所有被检查的正常组织中,OR2H1仅在睾丸中被发现了,这或许就表明,这种靶向作用OR2H1的疗法或许对正常细胞的影响很小。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


