《自然·癌症》:华人科学家发现特异性清除胃肠道癌细胞的新方法
来源:奇点糕 2022-04-30 08:47
胃肠道肿瘤(GIC,包括胃癌、胰腺癌、结直肠癌)和神经内分泌肿瘤(NET)一旦发生转移治疗方法有限、预后差。全世界每年约有500万例GIC新发病例,
胃肠道肿瘤(GIC,包括胃癌、胰腺癌、结直肠癌)和神经内分泌肿瘤(NET)一旦发生转移治疗方法有限、预后差。全世界每年约有500万例GIC新发病例,GIC相关死亡占所有癌症相关死亡的35%[1]。因此,寻找新的治疗方案是临床亟需解决的难题。
近年来,癌症免疫疗法取得突破性进展,尤其是嵌合抗原受体T细胞(CAR-T)过继细胞疗法对白血病/淋巴瘤疗效显著[2],但CAR-T对GIC和NET等实体瘤的治疗尚处于空白阶段,部分原因是缺乏合适的肿瘤特异性抗原和相应的单克隆抗体,因此探索安全且可靶向的肿瘤特异性抗原是解决这一挑战的关键。
近日,美国宾夕法尼亚大学华先欣教授及其团队分离出一种源自美洲驼🦙的纳米抗体(VHH1),这种抗体可与人肠上皮细胞及部分胰腺导管上皮细胞表面的肝肠钙粘蛋白17(CDH17)结合,VHH1-CAR-T细胞(CDH17CAR-Ts)以CDH17依赖的方式消除人和小鼠肿瘤细胞。
尤其值得一提的是,虽然健康组织细胞也会表达表达CDH17,但是正常细胞表面的CDH17位于肠上皮细胞之间的紧密连接处,而免受CDH17CAR-Ts的攻击[3]。
这一研究表明,CDH17是GIC和NET嵌合抗原受体T细胞治疗的理想靶点,为进一步探索肿瘤相关抗原和开发治疗实体肿瘤的安全免疫疗法提供了新的思路。相关研究成果,近期发表在著名期刊《自然·癌症》(Nature Cancer)上。

论文首页
接下来,我们看看这项研究是如何开展的。
首先,研究团队为了探索可用于免疫治疗的GIC-NET特异性抗体,使用未经免疫的美洲驼🦙外周血单个核细胞构建VHH(纳米抗体)噬菌体库,通过筛选分离出特异性结合NET的VHH1。
为了鉴定VHH1靶向的蛋白质抗原,研究人员制备了3000个人类细胞膜蛋白互补DNA,并将其转染到HEK293T(人胚肾细胞)细胞中,然后用表达VHH1的噬菌体进行筛选,分析发现,VHH1仅与细胞表面粘附蛋白CDH17结合。
CDH17又名肝肠钙粘蛋白,是一种具有七个胞外钙粘蛋白(EC)结构域的细胞粘附蛋白,主要表达于肠上皮细胞及部分胰腺导管上皮细胞,在GIC和NET肿瘤细胞中表达上调。
接下来,研究人员使用7个结构域单独发生突变的CDH17突变体去转染细胞,然后用流式细胞术去检测与VHH1的结合情况,研究发现,EC1结构域缺失的CDH17突变体丧失了与VHH1结合的能力,说明VHH1与EC1结构域特异性结合。
随后,研究人员对35例NET患者的肿瘤组织进行了免疫组织化学染色(IHC),结果显示,35例样本中19例(54.3%)高表达CDH17,其中,14例小肠来源的NET肿瘤组织中有12例(85.7%)CDH17染色阳性,而15例胰腺来源的NET肿瘤组织中有6例(40%)CDH17染色阳性。虽然NET肿瘤细胞存在肿瘤内异质性,一些肿瘤细胞失去了CDH17的表达,但在19例CDH17阳性的样本中有13例样本90%以上的肿瘤细胞高表达CDH17。
以上数据表明,CDH17是开发CAR-T疗法治疗NETs和其他胃肠道肿瘤的合适靶点。
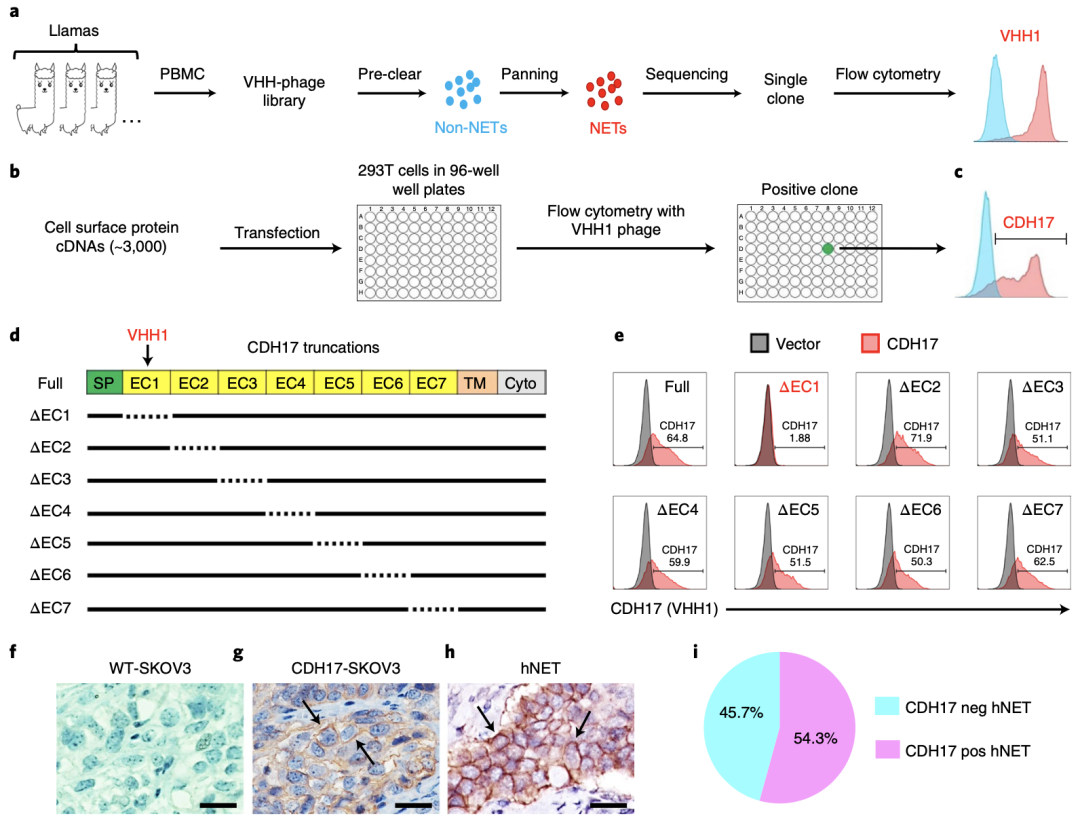
分离VHH1并证明其与在NETs中高度表达的CDH17特异性结合
那么,VHH1是否能够引导T细胞杀死NET肿瘤细胞呢?
首先,研究团队构建了CDH17特异性嵌合抗原受体T细胞:VHH1-CAR-T细胞(CDH17CAR-Ts)。已有研究表明,T细胞和靶细胞之间的距离对于免疫突触的形成,以及随后对靶细胞的杀伤至关重要[4]。
因此,研究人员构建了5种不同铰链长度的嵌合抗原受体(CAR):H38CAR(铰链区为IgG3 + CD8)、H3CAR(铰链区为IgG3)、H8CAR(铰链区为CD8)、H3sCAR(铰链区为IgG3s)、H4CAR(铰链区为IgG4)。随后,他们将这5种CARs以及空载体分别转导到人T淋巴细胞株JRT3,结果显示,转导较短铰链CAR(CD8、IgG3s和IgG4)的JRT3可以有效杀死BON细胞(人胰腺神经内分泌瘤细胞),但对BT474细胞(人乳腺导管癌细胞)没有杀伤作用。
接下来,研究人员用以上不同铰链长度的CARs转导人原代T细胞,得到了相同的结果,并且转导H4CAR(IgG4铰链区最短)的T细胞对肿瘤细胞的杀伤效果最好。
这些结果表明,转导短铰链的VHH1-CAR-T细胞可以特异性杀死人胰腺神经内分泌瘤细胞。
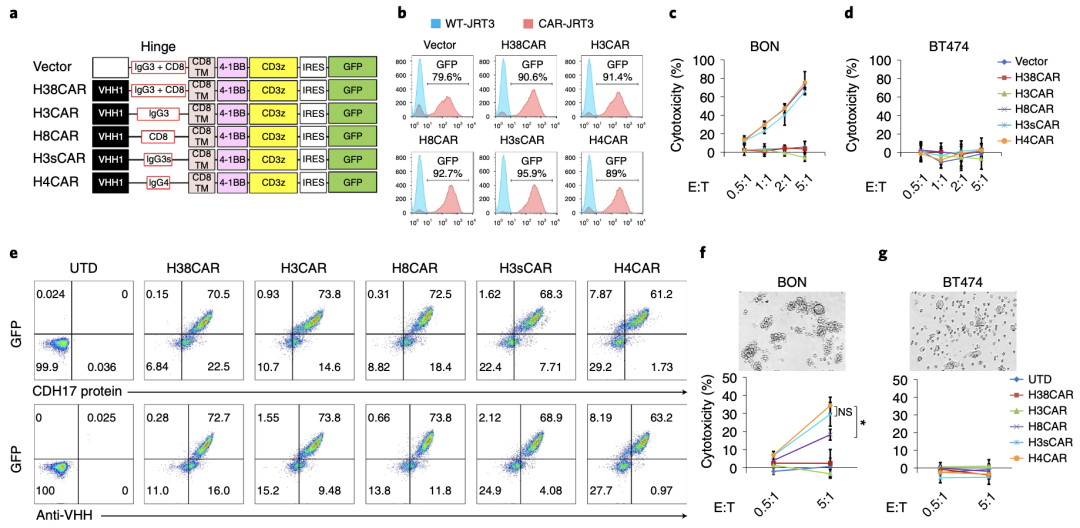
筛选可以特异性有效杀伤NETs细胞的嵌合抗原受体T细胞
接下来,研究人员为了探索是否能够进一步增强VHH1-CAR-T在杀死实体瘤方面的效力,分别构建了仅含有4-1BB共刺激结构域的第二代VHH1-CAR(VHH1-BBz)和包括CD28和4-1BB(VHH1-28BBz)两个共刺激结构域的第三代VHH1-CAR。
随后,用CDH17慢病毒转导人卵巢癌细胞(SKOV3细胞),进一步筛选出表达CDH17的SKOV3细胞,然后用VHH1-BBz-CAR-T和VHH1-28BBz-CAR-T分别与野生型SKOV3细胞(WT-SKOV3)和表达CDH17的SKOV3细胞(CDH17-SKOV3)共培养。
结果显示,两种VHH1-CAR-T在体外均能有效地杀死CDH17-SKOV3细胞,值得注意的是,VHH1-28BBz-CAR-T比VHH1-BBz-CAR-T更能有效地杀死CDH17-SKOV3细胞;同时,与CDH17-SKOV3细胞共培养时,VHH1-28BBz-CAR-T释放的干扰素(IFN)和肿瘤坏死因子(TNF)也比VHH1-BBz-CAR-T多,但与WT-SKOV3细胞共培养时两种嵌合抗原T细胞均未发现对肿瘤细胞的杀伤作用和细胞因子的释放,这表明CDH17诱导了CAR-T激活。
为了进一步评估两代VHH1-CAR-T在体内以CDH17依赖性方式抑制SKOV3异种移植肿瘤的效果,将WT或CDH17-SKOV3细胞分别移植到NSG小鼠体内,然后分别给小鼠注射未转导(UTD)T细胞和两代VHH1-CAR-T。
结果显示,对照组注射UTD T细胞的小鼠肿瘤呈指数增长,注射第二代VHH1-BBz-CAR-T可显著抑制肿瘤生长,但不能根除肿瘤,而注射第三代VHH1-28BBz-CAR-T可特异性根除CDH17-SKOV3肿瘤并且可以延长总生存期,但不影响CDH17阴性WT-SKOV3肿瘤的生长。以上结果,与流式细胞术分析结果一致,注射第三代VHH1-28BBz-CAR-T的荷瘤小鼠外周血中CD3+T细胞数量最高。
这一系列实验表明,第三代VHH1-28BBz-CAR-T以靶向CDH17依赖性方式在体内根除实体瘤。
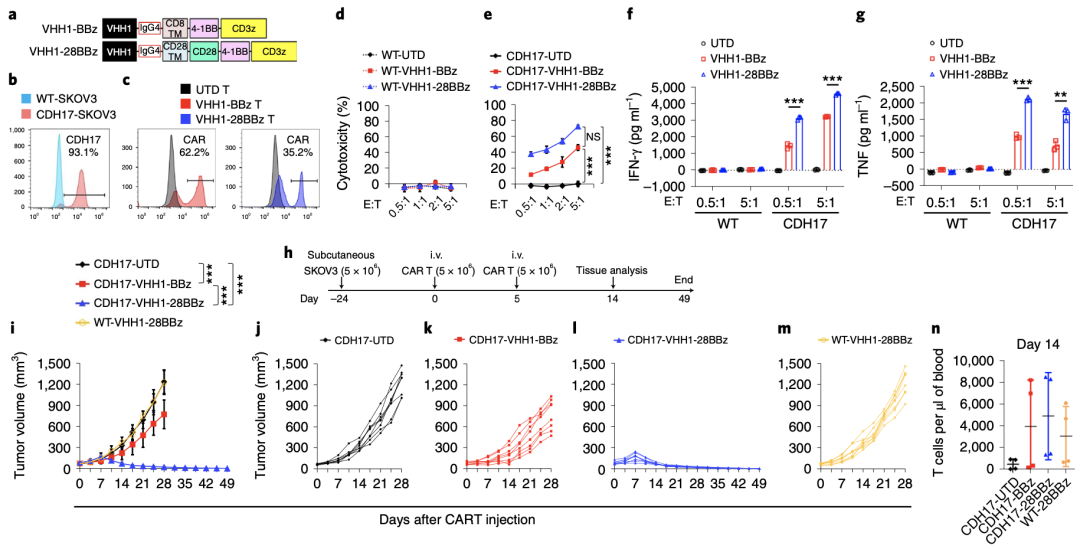
CDH17CAR-Ts在体内可消除表达CDH17的SKOV3实体瘤
随后,研究人员使用了一种新的高分化人胰腺神经内分泌肿瘤细胞(NT-3)进行了进一步验证,体外细胞毒性试验显示,VHH1-BBz-CAR-T和VHH1-28BBz-CAR-T在体外均能杀死NT-3细胞,其中第三代VHH1-28BBz-CAR-T对NT-3的杀伤效果更强,与NT-3细胞共培养时,释放的IFN-γ和TNF更多。
进一步体内动物试验结果显示,VHH1-BBz-CAR-T可以抑制NT-3肿瘤的生长,但没有消除肿瘤;值得注意的是,VHH1-28BBz-CAR-T在体内消除了NT-3肿瘤。
以上实验结果,研究人员在人胰腺癌细胞系ASPC1和HPAFII和两种胃癌细胞系SNU-16和SNU-5中得到了进一步验证。
肿瘤组织免疫化学染色和免疫荧光(IF)染色显示结果显示,注射UTD T细胞的小鼠,肿瘤组织中检测到胰岛样NT-3肿瘤细胞,注射第二代VHH1-BBz-CAR-T治疗的小鼠的NT-3肿瘤周围有大量小而细胞核密集的T细胞,注射第三代VHH1-28BBz-CAR-T治疗的小鼠未检测到NT-3肿瘤细胞,但检测到大量T细胞。另外,在注射VHH1-28BBz-CAR-T后,部分小鼠的肿瘤大小短暂增加,这可能是由于CAR-T迁移到肿瘤部位后大量增生并且释放细胞因子所致。
以上结果表明,表明第三代VHH1-28BBz-CAR-T肿瘤浸润和清除NET和GIC肿瘤细胞比第二代CAR-T更有效。
值得注意的是,与第二代CAR-T治疗后的小鼠中度体重减轻相比,第三代CAR-T治疗后没有观察到明显的体重减轻;在第一次注射CAR-T后第10天左右,小鼠肠道没有发现明显损伤,第二代VHH1-BBz-CAR-T治疗的小鼠肿瘤减小伴随体重减轻的原因目前尚不清楚。
此外,与注射UTD T细胞和VHH1-BBz-CAR-T相比,注射VHH1-28BBz-CAR-T治疗的小鼠循环血液中的CD3+T细胞数量最高。
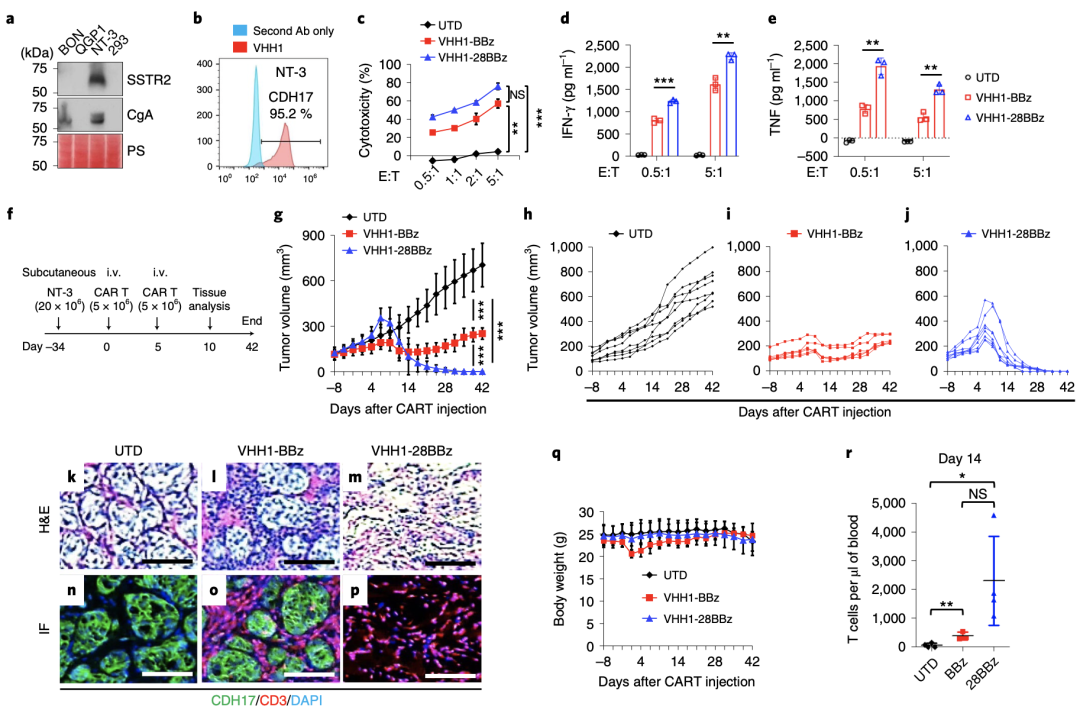
CDH17CAR-Ts在小鼠体内对NT-3肿瘤的杀伤作用
但是研究人员使用BON细胞进一步验证以上结果时发现,VHH1-28BBz-CAR-T可以显著抑制小鼠体内BON细胞形成的异种移植肿瘤,但不能消除肿瘤。这说明,VHH1-CAR-T以CDH17依赖性方式杀伤肿瘤细胞,然而,并非所有表达CDH17的肿瘤细胞对CAR-T介导的杀伤都同样敏感,BON细胞对CAR-T敏感性降低的机制值得进一步研究。
CAR-T治疗面临的一个重要问题就是对健康细胞的靶向毒性,CDH17在NET肿瘤细胞中高度表达,但也在人和小鼠肠上皮细胞中表达,那么,CDH17CAR-T在体内杀死肿瘤细胞的同时是否对健康的肠上皮细胞也有杀伤作用呢?
为了探索这一问题,研究团队首先检测了小鼠作为评估CAR-T治疗对正常细胞毒性的可行性,并构建了VHH1-28BBz-CAR(mCAR)的小鼠版本。
随后,研究人员建立了原位原发性结直肠癌(CRC)小鼠模型,将CRC小鼠注射mUTD T细胞或mVHH1-28BBz-CAR-T;在研究结束时,将小鼠杀死并解剖,在对照小鼠中显示出明显的肿瘤,经mCAR-T治疗的小鼠肿瘤负荷减轻,对照组和CAR-T治疗组小鼠的肿瘤总体积的定量分析表明,CAR-T注射显著减少了肿瘤体积;进一步组织学研究显示,mCAR-T注射小鼠的肿瘤中浸润的CD3+T细胞明显多于mUTD T细胞注射小鼠的肿瘤。
总之,这些实验结果表明,在这些同基因原位肿瘤模型中,mVHH1-28BBz-CAR-T可以显著降低原发性结直肠癌的肿瘤负荷,且肿瘤部位T细胞的浸润明显增加。
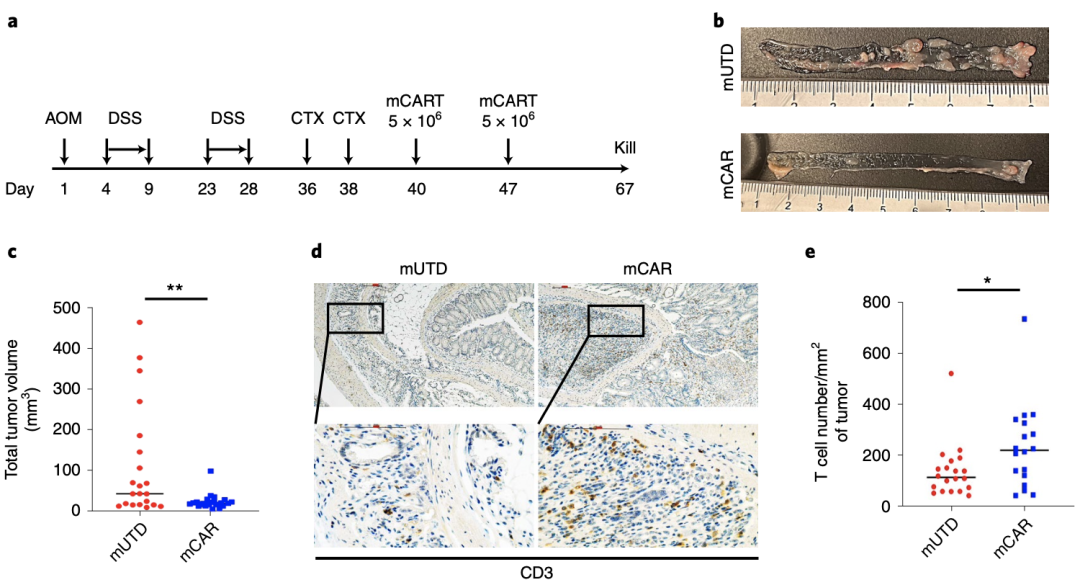
CDH17CAR-Ts可显著降低WT C57BL/6J小鼠中原发性结直肠癌肿瘤负荷
以上结果已证实VHH1可与人和小鼠CDH17结合,并且由此产生的CAR-Ts也能有效杀死小鼠肿瘤细胞,接下来,研究人员收集UTD T细胞或VHH1-CAR-T治疗10天的NT-3荷瘤NSG小鼠的健康组织,免疫组化染色显示,用VHH1-CAR-T治疗后,小肠和结肠完好无损,这些健康组织没有明显的组织损伤;此外,在胰腺、胃、心脏、肝脏和肾脏中也未观察到明显的组织损伤。
最后,研究人员通过免疫荧光(IF)染色检测了人CAR-T浸润到正常小鼠小肠和结肠的情况,结果显示,接受VHH1-CAR-T治疗的小鼠,在其高表达CDH17的NT-3肿瘤中观察到大量T细胞浸润,注射UTD T细胞的小鼠肿瘤中没有观察到T细胞的浸润。
值得注意的是,用UTD T细胞或VHH1-CAR-T治疗携带隐匿表达CDH17的NT-3肿瘤时,在小鼠的小肠或结肠中未发现T细胞浸润,尽管受体小鼠的正常组织具有丰富的CDH17表达。为了确保VHH1能够与健康小鼠组织中的内源性CDH17结合,研究人员使用VHH1和兔抗VHH抗体进行了IF染色,发现VHH1确实可以与表达CDH17的NT-3肿瘤,以及表达正常CDH17的小鼠小肠上皮细胞结合,但不能与CDH17阴性的胰腺或胃细胞结合。
值得注意的是,CDH17主要表达于小鼠肠上皮细胞的外侧,而不是顶端或基底侧,这表明VHH1-CAR-T不能靶向正常小肠或结肠的一个原因可能是VHH1-CAR-T不能到达或结合到肠上皮细胞紧密连接处外侧的CDH17。相比之下,由于缺乏极性,肿瘤细胞在其细胞表面表达CDH17,这可能会增强肿瘤细胞对CAR-T介导的杀伤的敏感性。那么,如果肠上皮的完整性受损,是否会有更多的T细胞渗入肠道呢?
随后,研究团队给野生型(WT)免疫活性小鼠注射mVHH1-CAR-T,然后将其分为两组,一组小鼠饮用纯净水,另一组小鼠饮用含有DSS(葡聚糖硫酸钠,是常见的诱导溃疡性结肠炎的药物)的水;结果显示,DSS治疗导致结肠长度缩短,组织学研究表明,DSS治疗会破坏肠上皮的完整性;定量分析表明,用DSS处理注射CAR-T的小鼠可显著增加CD3+T细胞向受损肠上皮的浸润。
虽然这项研究本身并不能直接证明紧密连接阻止了CAR-T,但它与肠上皮完整性或紧密连接对于阻止CAR-T渗透至关重要的观点是一致的。
以上研究结果表明,VHH1-CAR-T在根除表达CDH17的NT-3肿瘤的同时,保留了同样表达CDH17的健康小肠和结肠,表明用于开发治疗GIC和NET的CAR-T疗法,CDH17是一个安全有效的靶点。
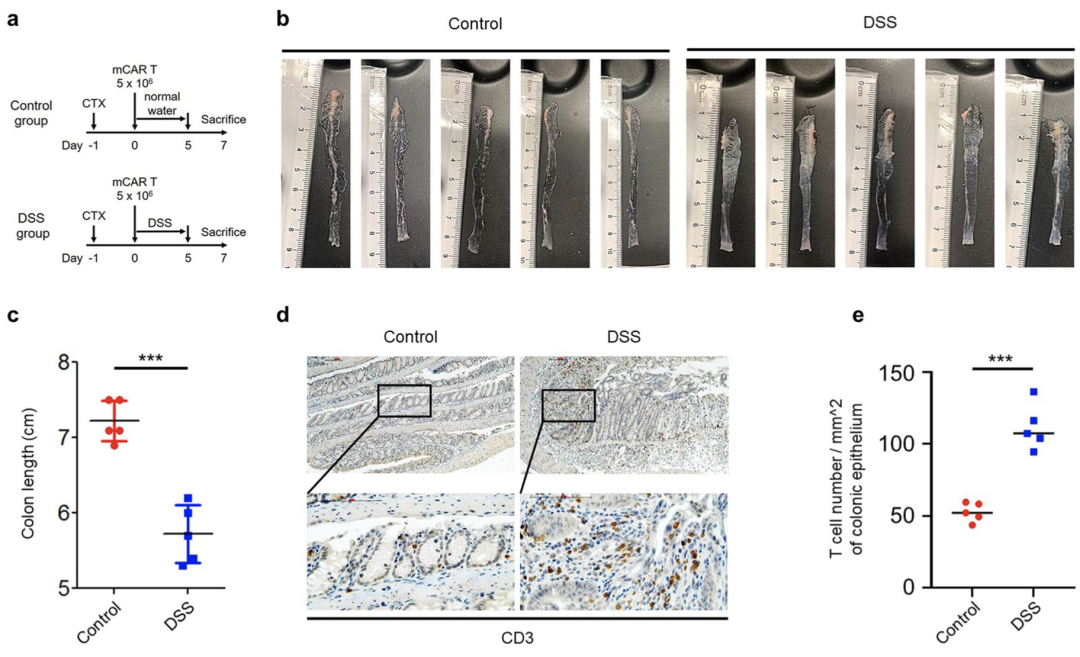
肠上皮损后T细胞向结肠浸润增加
肿瘤特异性抗原的缺乏是限制CAR-T用于治疗实体瘤(包括GIC和NETs)发展的主要挑战之一,因此需要确定安全且可靶向的TAA。
总的来说,本研究表明,CDH17是GIC和NET嵌合抗原受体T细胞治疗的理想靶点;CDH17在GIC和NET中表达上调;VHH1-CAR-Ts(CDH17CAR-Ts)可以根除表达CDH17的肿瘤,包括胰腺NET、GC、PC和CRC;在多种异种移植或原位肿瘤模型中可以根除CDH17阳性肿瘤。
最后,CDH17CAR-T在不影响小鼠体重和肠道组织学变化的情况下根除了肿瘤,大量CAR-Ts渗入肿瘤组织,但在小鼠的健康组织中,包括表达CDH17的小肠和结肠,没有发现这种浸润。总之,这项研究表明,CDH17是用于过继免疫治疗NET和其他CDH17阳性的实体瘤的潜在靶点。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


